
题目列表(包括答案和解析)
14.(2009·理综重庆卷,10)物质的量浓度相同的下列溶液,pH由大到小排列正确的是 ( )
A.Ba(OH)2、Na2SO3、FeCl3、KCl
B.Na2SiO3、Na2CO3、KNO3、NH4Cl
C.NH3·H2O、H3PO4、Na2SO4、H2SO4
D.NaHCO3、C6H5COOH、C2H5OH、HCl
13.(2009·理综天津卷,2,6分)25 ℃时,浓度均为0.2 mol/L的NaHCO3和Na2CO3溶液中,下列判断不正确的是 ( )
A.均存在电离平衡和水解平衡
B.存在的粒子种类相同
C.c(OH-)前者大于后者
D.分别加入NaOH固体,恢复到原温度,c(CO32 -)均增大
11.(2009·广东卷,9,)下列浓度关系正确的是( )
A.氯水中:c(Cl2) = 2[c(ClO-)+c(Cl-)+c(HClO)]
B.氯水中:c(Cl-)>c(H+)>c(OH-)>c(ClO-)
C.等体积等浓度的氢氧化钠与醋酸混合:
c(Na+) = c(CH3COO-)
D.Na2CO3溶液中:c(Na+)>c(CO32 -)>c(OH-)>c(HCO3- )>c(H+)
12.(2009·理综全国卷II,10)现有等浓度的下列溶液:①醋酸、②苯酚、③苯酚钠、④碳酸、⑤碳酸钠、⑥碳酸氢钠。按溶液pH由小到大排列正确的是 ( )
A.④①②⑤⑥③ B.④①②⑥⑤③
C.①④②⑥③⑤ D.①④②③⑥⑤
10.(2009·理综浙江卷,9,6分)已知单位体积的稀溶液中,非挥发性溶质的分子或离子数越多,该溶液的沸点就越高。则下列溶液沸点最高的是 ( )
A.0.01 mol·L-1的蔗糖溶液
B.0.01 mol·L-1的CaCl2溶液
C.0.02 mol·L-1的NaCl溶液
D.0.02 mol·L-1的CH3COOH溶液
9.(2009·广东卷,20)甲酸甲酯水解反应方程式为:HCOOCH3(l)+H2O(l) HCOOH(l)+CH3OH(l) DH>0
HCOOH(l)+CH3OH(l) DH>0
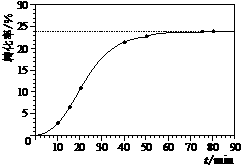
某小组通过实验研究该反应(反应过程中体积变化忽略不计)。反应体系中各组分的起始量如下表: 甲酸甲酯转化率在温度T1下随反应时间(t)的变化如下图:
甲酸甲酯转化率在温度T1下随反应时间(t)的变化如下图:

(1)根据上述条件,计算不同时间范围内甲酸甲酯的平均反应速率,结果见下表: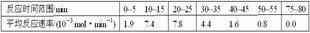 请计算15-20 min范围内甲酸甲酯的减少量为
mol,甲酸甲酯的平均反应速率为_________mol·min-1(不要求写出计算过程)。
请计算15-20 min范围内甲酸甲酯的减少量为
mol,甲酸甲酯的平均反应速率为_________mol·min-1(不要求写出计算过程)。
(2)依据以上数据,写出该反应的反应速率在不同阶段的变化规律及其原因: ___________。
(3)上述反应的平衡常数表达式为:K =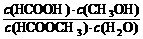 ,则该反应在温度T1下的K值为
。
,则该反应在温度T1下的K值为
。
(4)其他条件不变,仅改变温度为T2(T2大于T1),请在下图中画出温度T2下甲酸甲酯转化率随反应时间变化的预期结果示意图。
8.(2009·理综辽宁、宁夏卷,13)在一定温度下,反应 H2(g)+
H2(g)+ X2(g)
X2(g) HX(g)的平衡常数为10。若将1.0 mol的HX(g)通入体积为1.0 L的密闭容器中,在该温度时HX(g)的最大分解率接近于( )
HX(g)的平衡常数为10。若将1.0 mol的HX(g)通入体积为1.0 L的密闭容器中,在该温度时HX(g)的最大分解率接近于( )
A.5% B.17%
C.25% D.33%
7.(2008江苏化学17)(10分)工业上制备BaCl2的工艺流程图如下:

某研究小组在实验室用重晶石(主要成分BaSO4)对工业过程进行模拟实验。查表得
BaSO4(s) + 4C(s) 4CO(g) + BaS(s)
△H1 = 571.2 kJ·mol-1 ①
4CO(g) + BaS(s)
△H1 = 571.2 kJ·mol-1 ①
BaSO4(s) + 2C(s) 2CO2(g) + BaS(s) △H2= 226.2 kJ·mol-1 ②
2CO2(g) + BaS(s) △H2= 226.2 kJ·mol-1 ②
(1)气体用过量NaOH溶液吸收,得到硫化钠。Na2S水解的离子方程式为 。
(2)向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时, =
。
=
。
[Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10]
(3)反应C(s) + CO2(g) 2CO(g)的△H2= kJ·mol-1。
2CO(g)的△H2= kJ·mol-1。
(4)实际生产中必须加入过量的炭,同时还要通入空气,其目的是 , 。
6.(2007年高考广东化学卷·26) (12分)羟基磷灰石[Ca5(PO4)3OH]是一种重要的生物无机材料,其常用的制备方法有两种:
方法A:用浓氨水分别调Ca(NO3)2和(NH4)2HPO4溶液的pH约为12;在剧烈搅拌下,将(NH4)2HPO4溶液缓慢滴入Ca(NO3)2溶液中。
方法B:剧烈搅拌下,将H3PO4溶液缓慢滴加到Ca(OH)2悬浊液中。

3种钙盐的溶解度随溶液pH的变化如上图所示(图中纵坐标是钙离子浓度的对数),回答下列问题:
⑴完成方法A和方法B中制备Ca5(PO4)3OH的化学反应方程式:
①5Ca(NO3)2+3(NH4)2HPO4+4NH3·H2O=Ca5(PO4)3OH↓+________+_______,
②5Ca(OH)2+3H3PO4=__________________________。
⑵与方法A相比,方法B的优点是_________________。
⑶方法B中,如果H3PO4溶液滴加过快,制得的产物不纯,其原因是__________。
⑷图中所示3种钙盐在人体中最稳定的存在形式是_____________(填化学式)。
⑸糖黏附在牙齿上,在酶的作用下产生酸性物质,易造成龋齿。结合化学平衡移动原理,分析其原因________________。
5.(2008广东化学9)已知Ag2SO4的KW 为2.0×10-3,将适量Ag2SO4固体溶于100 mL水中至刚好饱和,该过程中Ag+和SO 浓度随时间变化关系如右图(饱和Ag2SO4溶液中c(Ag+)=0.034mol·L-1)。若t1时刻在上述体系中加入100 mL. 0.020 mol·L-1 Na2SO4 溶液,下列示意图中,能正确表示t1时刻后Ag+和SO
浓度随时间变化关系如右图(饱和Ag2SO4溶液中c(Ag+)=0.034mol·L-1)。若t1时刻在上述体系中加入100 mL. 0.020 mol·L-1 Na2SO4 溶液,下列示意图中,能正确表示t1时刻后Ag+和SO 浓度随时间变化关系的是
浓度随时间变化关系的是
4.(2008·山东理综卷,15,)某温度时,BaSO4在水中的沉淀溶解平衡曲线如下图所示。下列说法正确的是 ( )
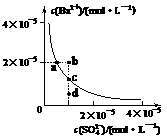
提示:BaSO4(s) Ba2+(aq)+SO42 -(aq)的平衡常数:Ksp = c(Ba2+)·c(SO42 -),称为溶度积常数。
Ba2+(aq)+SO42 -(aq)的平衡常数:Ksp = c(Ba2+)·c(SO42 -),称为溶度积常数。
A.加入Na2SO4可以使溶液由a点变到b点
B.通过蒸发可以使溶液由d点变到c点
C.d点无BaSO4沉淀生成
D.a点对应的Ksp大于c点对应的Ksp
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com