
题目列表(包括答案和解析)
5.(2008广东化学13)元素X、Y和Z可结合形成化合物XYZ3;X、Y和Z的原子序数之和为26;Y和Z在同一周期。下列有关推测正确的是( )
A.XYZ3是一种可溶于水的酸,且X与Y可形成共价化合物XY
B.XYZ3是一种微溶于水的盐,且X与Z可形成离子化合物XZ
C.XYZ3是一种易溶于水的盐,且Y与Z可形成离子化合物YZ
D.XYZ3是一种离子化合物,且Y与Z可形成离子化合物YZ3
4.(2008广东理基27)根据表1信息,判断以下叙述正确的是 ( )
表1 部分短周期元素的原子半径及主要化合物
|
元素代号 |
I |
M |
Q |
R |
T |
|
原子半径/mm |
0.160 |
0.143 |
0.112 |
0.104 |
0.066 |
|
主要化合价 |
+2 |
+3 |
+2 |
+6、+2 |
-2 |
A.氢化物的沸点为H2T<H2R
B.单质与稀盐酸反应的速率为L<Q
C.M与T形成的化合物具有两性
D.L2+与R2-的核外电子数相等
3.(2007广东理基21) 32S与33S互为同位素,下列说法正确的是 ( )
A.32S与33S 原子的最外层电子数均为2
B.32S与33S具有相同的中子数
C.32S与33S具有不同的电子数
D.32S与33S具有相同的质子数
2.(2007宁夏理综9)下列叙述错误的是 ( )
A.13C和14C属于同一种元素,它们互为同位素
B.1H和2H是不同的核素,它们的质子数相等
C.14C和14N的质量数相等,它们的中子数不等
D.6Li和7Li的电子数相等,中子数也相等
1.(2007广东化学1)铋(Bi)在医药方面有重要应用。下列关于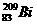 和
和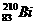 的说法正确的是( )
的说法正确的是( )
A.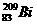 和
和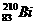 都含有83个中子
都含有83个中子
B.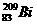 和
和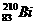 互为同位素
互为同位素
C.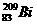 和
和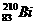 的核外电子数不同
的核外电子数不同
D.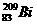 和
和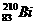 分别含有126和127个质子
分别含有126和127个质子
32.答案: (1)[Ar]3d9或1s22s22p63s23p63d9。 (2)4个。 (3)BD。
(4)F的电负性比N大,N-F成键电子对向F偏移,导致NF3中N原子核对其孤对电子的吸引能力增强,难以形成配位键,故NF3不易与Cu2+形成配离子。
(5)高 Cu2O与Cu2S相比,阳离子相同,阴离子所带的电荷数也相同,但O2-半径比S2-半径小,所以Cu2O的晶格能更大,熔点更高。
[解析](2)用均摊法可知含阴离子数为:8× +4×
+4× +2×
+2× +1 = 4。
+1 = 4。
(3)端点的原子不杂化,而图示结构的SO4单元中含有端点氧原子,所以A项不正确。铜离子与SO42 -之间存在离子键,B项正确。胆矾是离子晶体,C项不正确。由图结构可知,胆矾中有1个水分子与其它粒子靠氢键结合,易失去,有4个水分子与Cu2+以配位键结合,较难失去,所以D项正确。
(4)对比NH3与NF3结构可知,F的电负性比N大,N-F成键电子对向F偏移,使NF3中N原子上显正电性,难以形成配位键。
31.答案 (1)1s2s22p63s23p2; O>C>Si。 (2)sp3; 共价键。
(3)Mg; Mg2+半径比Ca2+小,MgO晶格能大。
(4)C的原子半径较小,C、O原子能充分接近,p-p轨道肩并肩重叠程度较大,形成较稳定的p 键。
而Si的原子半径较大,Si、O原子间距离较大,p-p轨道肩并肩重叠程度较小,不能形成上述稳定的p键。
[解析](1)C、Si和O的电负性大小顺序为:O>C>Si。
(2)晶体硅中一个硅原子周围与4个硅原子相连,呈正四面体结构,所以杂化方式是sp3。
(3)晶格能与所组成离子所带电荷成正比,与离子半径成反比,MgO与CaO的离子电荷数相同,Mg2+半径比Ca2+小,MgO晶格能大,所以熔点高。
30.答案: (1)氢(1分)
(2)F; Cl; 氟化氢分子间存在氢键,氯化氢分子间没有氢键(3分)
(3)四 VIIB 锰 1s22s22p63s23p63d5(4分)
(4)CaF2
 (3分)
(3分)
[解析]从E是周期表中1-18列中E排第7列可判断E是第4周期VIIB族,所以E是Mn,继而推出D是Ca;从图中离子化合物D(Ca):B = 1:2知,B为VIIA族,再从原子序数B<C<D(Ca)和B、C同主族知:B为第二周期的F、C为第三周期的Cl;A与其他4种元素既不在同一周期又不在同一主族,所以A为H。
(3)从锰在周期表中的位置可知价电子构型为3d54s2,+2价时失去2个电子,故排布式为[Ar]3d5。
(4)r =  = (40+38)×4÷(6.02×1023)g÷V = a g·cm-3
= (40+38)×4÷(6.02×1023)g÷V = a g·cm-3
V = 
29.答案: (1)1s22s22p63s23p63d104s2或[Ar]3d104s2。
(2)C≡O。 (3)①甲醇分子之间形成氢键; sp2杂化。 ②平面三角形; 3NA; ③4。
[解析](2)CO与N2是等电子体,等电子体具有相同的空间构型,C、O之间共用3对共用电子对。
(3)①CH3OH中含有-OH,能形成氢键。②甲醛结构为 ,平面三角形,C原子采取sp2杂化方式成键,结构中含有3个δ键,1个π键。③晶胞中含白球为:8×
,平面三角形,C原子采取sp2杂化方式成键,结构中含有3个δ键,1个π键。③晶胞中含白球为:8× +1 = 2个,黑球为4个,原子个数比为1:2,则包含4个Cu原子,2个O原子。
+1 = 2个,黑球为4个,原子个数比为1:2,则包含4个Cu原子,2个O原子。
28.答案: (1)1s22s22p63s23p63d104s24p3 As。
(2) 或
或 氧。 (3)三角锥。
氧。 (3)三角锥。
(4)As2O3+6Zn+6H2SO4 = 2AsH3↑+6ZnSO4+3H2O。
(5)稳定性:NH3>PH3>AsH3 因为键长越短,键能越大,化合物越稳定;
沸点:NH3>AsH3>PH3 NH3可形成分子间氢键,沸点最高,AsH3相对分子质量比PH3大,分子间作用力大,因而AsH3比PH3沸点高。
[解析](1)X元素原子的4p轨道上有3个未成对电子,可通过写电子排布式得到X为33号元素As;(2)Y元素原子的最外层2p轨道上有2个未成对电子,从电子排布式可知为O或C,再从化合物X2Y3(As2Y3)可确定Y为O;最后据三者原子序数和为42可得Z为H。(3)AsH3的结构与NH3相似(As为sp3杂化),分子形状为三角锥型。
[点评]涉及电子排布的问题,一般相对简单,这也是目前选修科目的一个趋势。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com