
题目列表(包括答案和解析)
具有完全相同的组成的原子排列,但互为镜像,在三维空间不能重叠的分子,互称为
。有手性异体的分子叫手性分子。
思考:形成手性异构的条件?
无机含氧酸的酸性:
通常在无机含氧酸中非羟氧的数目 ,酸性越强;对于同一种元素的含氧酸,
该元素的 越高,含氧酸酸性越强。
试题枚举
[例1]下列分子的立体结构,其中属于直线型分子的是 ( )
A.H2O B.CO2 C.C2H2 D. P4
解析:多原子分子若要属于直线型分子,中心原子应采用sp杂化,且无孤对电子
答案:B C。
[例2] 、
、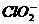 、
、 、
、 中Cl都是以sp3杂化轨道与O原子成键的,试推测下列微粒的立体结构
中Cl都是以sp3杂化轨道与O原子成键的,试推测下列微粒的立体结构
|
微粒 |
 |
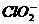 |
 |
 |
|
立体结构 |
|
|
|
|
解析:杂化轨道数相同,但孤对电子数同
答案:直线;V型;三角锥形;正四面体
[例3]下列物质的分子中,键角最小的是
A.H2O B.BF3 C.NH3 D.CH4
解析:BF3中的硼为sp2杂化,无孤对电子,键角120°;H2O、NH3、CH4中中心原子均为sp3杂化,H2O 中有两对孤对电子,对共用电子对“压迫”较大,键角最小
答案:A
[例4]铵根离子中存在的化学键类型按离子键、共价键和配位键分类,应含有
A.离子键和共价键 B.离子键和配位键 C.配位键和共价键 D.离子键
解析:铵根离子中N原子最外层5个电子,采用sp3杂化形成4个杂化轨道,其中一个杂化轨道被孤对电子占据,与H+的空轨道形成配位键;另三个轨道与H形成共价键
答案:C
[例5]根据“相似相溶”规律,你认为下列物质在水中溶解度较大的是( )
A .乙烯 B .二氧化碳 C.二氧化硫 D.氢气
解析:A B D非极性分子
答案:C
[例6]下列氯元素含氧酸酸性最强的是 ( )
A.HClO B.HClO2 C.HClO3 D.HClO4
解析: D分子中非羟基氧数目大
答案:D
[例7]在有机物分子中,若某个碳原子连接着四个不同的原子或原子团,这种碳原子称
为“手性碳原子”。凡有一个手性碳原子的物质一定具有光学活性,物质
CH3COOCH2-CH-CHO有光学活性,发生下列反应后生成的有机物无光学活性的是

A.与甲酸发生酯化反应 B.与NaOH水溶液共热
C.与银氨溶液作用 D.在催化剂存在下与H2作用
解析: 手性碳原子应连接着四个不同的原子或原子团
答案:B D
正电中心和负电中心不重合的分子叫 分子,分子的极性来自化学键的极性,只含非极性键的分子一定是非极性分子;含有极性键的分子是否具有极性可根据极性键的极性的 是否等于零来判断。
思考:为什么BF3是非极性分子而NH3是极性分子?
非极性溶质一般易溶于 ,极性溶质一般易溶于 ,这一经验
规律叫做“相似相溶”,若溶质与溶剂分子能形成氢键,则溶解性好。
某一分子离子提供孤对电子, 提供空轨道形成的特殊一种的 叫配位键,
通常把 的化合物称为配位化合物,简
称配合物,过渡金属易形成配物。
杂化轨道理论要点:
①只有 原子轨道才能杂化
②原子轨道杂化时,轨道 不变,轨道的形状发生变化
③原子轨道杂化后总能量比原有轨道能量之和降低
④杂化轨道只于形成δ键
⑤sp杂化轨道夹角 ,sp2杂化轨道夹角 ,sp3杂化轨道夹角 。
思考:怎样判断有几个轨道参与了杂化?
价层电子对互斥模型把分子分成两大类:一类是 ,如CO2、CH4等,其立体结构可用 周围的原子数n灰预测,如ABn,n=2,
形,n=3, 形,n=4, 形;另一类是 的分子。
15.(10分)把大气中的游离态的氮转化为氮的化合物的过程称为固氮。生物固氮和大气固氮(闪电时N2转化为NO)属于自然固氮,这远不能满足人类的需要。工业固氮(合成氨)是目前人工固氮的主要方法。有关大气固氮和工业固氮的平衡常数K值分别如下表一和表二。
表一:N2 + O2 ⇌2NO
|
温度 |
27℃ |
2000℃ |
|
K值 |
3.84×10-31 |
0.1 |
表二:N2 + 3H2 ⇌2NH3
|
温度 |
25℃ |
350℃ |
400℃ |
450℃ |
|
K值 |
5×108 |
1.847 |
0.507 |
0.152 |
(1)根据上表中的数据分析,下列说法正确的是_________。
a.在常温下,大气固氮几乎不可能,而工业固氮非常容易进行
b.人类大规模模拟大气固氮是无意义的
c.在常温下,大气固氮与工业固氮完成程度相差很大
d.大气固氮与工业固氮都是放热反应
(2)在一定条件下,工业固氮在一固定体积的密闭容器中进行直至平衡,有人画出了下列图像a和b;达到平衡后,向密闭容器中分别充入稀有气体或升高温度,有人又分别画出了如下图像c和d。其中有关图像正确的是______________(填编号)。

 (3)在一定条件下,工业固氮反应在体积为VL的
(3)在一定条件下,工业固氮反应在体积为VL的
密闭容器中进行,有关图像如右图,则用H2
表示从开始到平衡时该反应的平均速率:
14.(10分) 将一定量的SO2和含0.7mol氧气的空气(忽略CO2)放入一定体积的密闭容器中,550℃时,在催化剂作用下发生反应:2SO2+O2  2SO3 ΔH <0。反应达到平衡后,将容器中的混合气体通过过量NaOH溶液,气体体积减少了21.28L;再将剩余气体通过焦性没食子酸的碱性溶液吸收O2,气体的体积又减少了5.6L(以上气体体积均为标准状况下的体积)。请回答下列问题(计算结果保留一位小数):
2SO3 ΔH <0。反应达到平衡后,将容器中的混合气体通过过量NaOH溶液,气体体积减少了21.28L;再将剩余气体通过焦性没食子酸的碱性溶液吸收O2,气体的体积又减少了5.6L(以上气体体积均为标准状况下的体积)。请回答下列问题(计算结果保留一位小数):
(1)判断该反应达到平衡状态的标志是 。(填字母)
a.SO2和SO3浓度相等 b.SO2百分含量保持不变
c.容器中气体的压强不变 d.SO3的生成速率与SO2的消耗速率相等
e.容器中混合气体的密度保持不变
(2)欲提高SO2的转化率,下列措施可行的是 。(填字母)
a.向装置中再充入N2 b.向装置中再充入O2
c.改变反应的催化剂 d.升高温度
(3)求该反应达到平衡时SO2的转化率(用百分数表示)为__________。
(4)若将平衡混合气体的5%通入过量的BaCl2溶液,生成沉淀________克?
13.(10分)设反应①Fe(s)+CO2(g) FeO(s)+CO(g) △H
= Q1的平衡常数为K1,
FeO(s)+CO(g) △H
= Q1的平衡常数为K1,
反应②Fe(s)+H2O(g) FeO(s)+H2(g) △H = Q2的平衡常数为K2,在不同温度下,K1、K2的值如下:
FeO(s)+H2(g) △H = Q2的平衡常数为K2,在不同温度下,K1、K2的值如下:
|
温度( T ) |
K1 |
K2 |
|
973 |
1.47 |
2.38 |
|
1173 |
2.15 |
1.67 |
(1)从上表可推断,反应①是________(填“放”或“吸”)热反应;
(2)现有反应③H2(g)+CO2(g) CO(g)+H2O(g) △H = Q3
CO(g)+H2O(g) △H = Q3
①根据反应①与②推导出K1、K2、K3的关系式K3=_____________;可推断反应③是________(填“放”或“吸”)热反应。要使反应③在一定条件下建立的平衡右移,可采取的措施有__________。
A.缩小容器体积 B.降低温度 C.使用合适的催化剂
D.设法减少CO的量 E.升高温度
②根据反应①与②推导出Q1、Q2、Q3的关系式Q3 =_____________;
12.(10分)将等物质的量的A、B、C、D四种物质混合,发生如下反应:aA+bB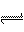 cC(s)+dD,当反应进行一定时间后,测得A减少了n
mol,B减少了
cC(s)+dD,当反应进行一定时间后,测得A减少了n
mol,B减少了 mol,C增加了
mol,C增加了 n mol,D增加了n mol,此时达到化学平衡。请填写下列空白:
n mol,D增加了n mol,此时达到化学平衡。请填写下列空白:
(1)该化学方程式各物质的化学计量数为a=__________、b=__________、c=__________、d=__________。
(2)若只改变压强,反应速率发生变化,但平衡不发生移动,该反应中物质D的聚集状态为
__________。
(3)若只升高温度,反应一段时间后,测知四种物质其物质的量又达到相等,则该反应为__________反应(填“放热”或“吸热”)。
11.(10分) 在一定体积的密闭容器中,进行如下化学反应:其化学平衡常数K与温度t的关系如下:CO2(g)+H2(g)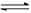 CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
|
t℃ |
700 |
800 |
830 |
1000 |
1200 |
|
K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
请回答下列问题:(1)该反应的化学平衡常数K = 。
(2)该反应为 反应。(填“吸热”或“放热”)
(3)800℃,固定容器的密闭容器中,放入混合物,其始浓度为c(CO)=0.01 mol/L, c(H2O)=0.03mol/L, c(CO2)=0.01 mol/L, c(H2)=0.05 mol/L ,则反应开始时,H2O的消耗速率比生成速率 (填"大"、"小"或"不能确定")
(4)830℃,在1L的固定容器的密闭容器中放入2 mol CO2和1 mol H2,平衡后CO2的转化率为 , H2的转化率为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com