
题目列表(包括答案和解析)
12. 目前人们正在研究开发一种高能电池--钠硫电池,它是以熔融的钠、硫为两
 极,以Na+导电的β-Al2O3陶瓷作固体电解质,反应式为:2Na+xS Na2Sx
极,以Na+导电的β-Al2O3陶瓷作固体电解质,反应式为:2Na+xS Na2Sx
(1)电池放电时正负极的电极反应式:
 正极反应式:___________________;负极反应式:____________________。
(2)用该电池作电源进行电解含有0.2mol CuSO4和0.2molNaCl的混合溶液500ml时:若 此电池工作一段时间后消耗23g Na 。则阳极产生气体体积为:________L(标准状况下);电解后溶液加水稀释至2 L ,溶液的pH为:________。
正极反应式:___________________;负极反应式:____________________。
(2)用该电池作电源进行电解含有0.2mol CuSO4和0.2molNaCl的混合溶液500ml时:若 此电池工作一段时间后消耗23g Na 。则阳极产生气体体积为:________L(标准状况下);电解后溶液加水稀释至2 L ,溶液的pH为:________。
11. 解:⑴ 设反应①中乙烯的投料为x,则得到乙酸为x×75%×80%
设反应②中乙烯的投料为y,则有
x×75%×80%×75%∶y×75%=2∶2
x∶y=5∶3 (3分)
⑵ 2.8×106kg×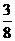 ×75%×
×75%×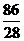 =2.42×106kg (3分)
=2.42×106kg (3分)
⑶ 设反应①中投入乙烯为5a,则反应中投入乙烯为3a
反应①中最少消耗氧气2.5a,生成乙醛0.75×5a=3.75a
反应②中最少消耗氧气 ×3.75a=1.875a
×3.75a=1.875a
反应③中最少消耗氧气1.5a
即最少共消耗氧气:5.875a,相当于5.875a×5=29.375a
通入的空气与乙烯的体积比的最小值为29.375a∶8a=3.68 (4分)

11. 醋酸乙烯酯是合成维尼纶的重要单体,某化工厂利用下列反应原理生产醋酸乙烯酯:
2CH2=CH2+O2 2CH3CHO ……………………①
2CH3CHO ……………………①
2CH3CHO+O2 2CH3COOH ……………………②
2CH3COOH ……………………②
2CH2=CH2+O2+2CH3COOH 2CH3COOCH=CH2 ……………③
2CH3COOCH=CH2 ……………③
由于副反应的发生,反应①中乙烯的利用率为75%,反应②中乙醛的利用率为80%,反应③中乙酸与乙烯的利用率均为75%。
⑴ 为使醋酸乙烯酯获得最大产量,乙烯先后两次的投料比为 ;
⑵ 以2.8×106kg乙烯为原料,最多可制得醋酸乙烯酯 kg;
⑶ 若各步副反应中反应物物质的量之比均与主反应相同,以乙烯和空气为原料,生产醋酸乙烯酯。计算:通入的空气(O2的体积分数为1/5)与乙烯的体积比的最小值。
10. ⑵FeCl2 0.912 g
⑶①0.180 L(或180 mL)
②0.105mol<n(Cu)<0.315mol
10. 钢铁制品经常进行烤蓝处理,即在铁制品的表面生成一层致密的Fe3O4。某学习小组为了研究烤蓝铁片,分别进行了以下实验操作:
⑴把一定量烤蓝铁片加工成均匀粉末。
 ⑵取m g该粉末,放人28.00 mL 1 mol/L。的盐酸中,恰好完全反应,生成标准状况下的气体134.4 mL,向溶液中滴入KSCN溶液,无明显现象。则:反应后溶液中的溶质是
(写化学式),m=
。
⑵取m g该粉末,放人28.00 mL 1 mol/L。的盐酸中,恰好完全反应,生成标准状况下的气体134.4 mL,向溶液中滴入KSCN溶液,无明显现象。则:反应后溶液中的溶质是
(写化学式),m=
。
⑶再取三份不同质量的粉末,分加加到相同体积(V)、物质的量浓度均为l0.00 mol/L的三份硝酸溶液中,充分反应后,固体全部溶解,有关的实验数据如下表所示(假设NO是硝酸的唯一还原产物):
|
实验序号 |
Ⅰ |
Ⅱ |
Ⅲ |
|
加入粉末质量/g |
13.68 |
27.36 |
34.20 |
|
生成气体的体积(标准状况)/L |
2.912 |
5.824 |
6.720 |
 ①试计算每份硝酸溶液的体积(V)是多少?
①试计算每份硝酸溶液的体积(V)是多少?
②若向实验Ⅱ所得溶液中继续加入铜粉,要使溶液中Cu2十、Fe2+、Fe3+同时存在,则加入铜粉的物质的量范围是 。
0.2 0.1 0.2 14.2 14.2 14.2 27.4 27.4
n(CaCO3)=27.4 mol;n(C)=14.4 mol;
∴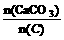 =1.90················································(4分)
=1.90················································(4分)
解二:由电子守恒法计算,略。
9. (1)425.6····························(1分)
(2)y=(176x+24)×22.4 m3·········(2分)
图像如右图:·····················(1分)
(3)解一:设窑气为100 mol,则n(N2)=100-41.6-0.2-0.2=58 mol,总共有n(O2)=58/4=14.5 mol;故参加反应的n(O2)=14.5 mol-0.2 mol=14.3 mol;
2C + O2 = 2CO C + O2 = CO2 CaCO3=CO2↑+CaO
2 1 2 1 1 1 1 1
9. 工业上利用焦炭在石灰窑中燃烧放热,使石灰石分解生产CO2:
|
CaCO3 CO2↑+CaO·············②
 (1)含碳酸钙95%的石灰石2.0 t按②完全分解(设杂质不分解),可得标准状况下CO2的体积为 ▲ m3。
(1)含碳酸钙95%的石灰石2.0 t按②完全分解(设杂质不分解),可得标准状况下CO2的体积为 ▲ m3。
(2)纯净的CaCO3和焦炭混合物2.4 t按①、②完全反应。若焦炭的质量分数为x,在石灰窑中充分反应生成标准状况下的CO2气体共y m3。写出y关于x的函数关系式 ▲ ,并在右图中绘出示意图(注明起始等重要点的坐标)。
(3)某次窑气体积分数如下:O2 0.2%、CO 0.2%、CO2 41.6%,其余为N2。则此次窑内配比率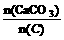 = ▲ (保留1位小数,设空气只含N2与O2,且体积比为4∶1)。
= ▲ (保留1位小数,设空气只含N2与O2,且体积比为4∶1)。
8. (1)192kg(2)1∶10 (3)227.6kg
8. 以天然气为原料合成氨是新的生产氮肥的方法,它具有污染小、成本低等诸多特点,其过程大体如图,某工厂以标准状况下的含CH489.6%的天然气100m3为原料经过上述过程,生产尿素和硝酸铵。
 (1)合成氨生产过程中氨的产率为60%,假设其他各步反应均完全且不考虑副反应,求100m3的天然气可生产尿素的质量。
(1)合成氨生产过程中氨的产率为60%,假设其他各步反应均完全且不考虑副反应,求100m3的天然气可生产尿素的质量。
(2)为使硝酸生产过程中不再补充空气,假设各步反应均完全且氨中氮元素全部转化为HNO3,空气中氧气体积分数设为20%,求由氨气和空气组成的原料气中(不包含被硝酸吸收的氨气)氨气与空气的体积比。
(3)实际生产中,若氨的产率为60%,硝酸的产率为80%,求100m3的天然气最多可生产硝酸铵的质量。

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com