
题目列表(包括答案和解析)
2. (1) 21.43 (2)17.53 (3)53.33
2. 某工厂的生产废水中含糖类[以(CH2O)n表示],该厂用化学和生物方法处理废水,若废水中的糖类有45%被完全氧化,即发生反应 (CH2O)n + nO2
→ nCO2 +
nH2O;另有10% 经过发酵过程进行无氧分解,即 2(CH2O)n
→ nCO2
+ nCH4 。其余部分糖类仍然留在沉积物中。该厂每天处理废水得到的CO2和CH4共16.0m3(标准状况)。
某工厂的生产废水中含糖类[以(CH2O)n表示],该厂用化学和生物方法处理废水,若废水中的糖类有45%被完全氧化,即发生反应 (CH2O)n + nO2
→ nCO2 +
nH2O;另有10% 经过发酵过程进行无氧分解,即 2(CH2O)n
→ nCO2
+ nCH4 。其余部分糖类仍然留在沉积物中。该厂每天处理废水得到的CO2和CH4共16.0m3(标准状况)。
 (1)每天被氧化和被发酵的糖类共
千克。(2)每天有
千克糖类留在沉积物中。
(1)每天被氧化和被发酵的糖类共
千克。(2)每天有
千克糖类留在沉积物中。
(3)COD(化学耗氧量)是指1L水样中还原性物质完全被氧化所需要的氧气的毫克数。若该工厂的生产废水中糖类的质量分数为百万分之五十(设废水的密度为1g/cm3;无其它还原性物质),则其COD为 mg/L.
1. (1)[Al(OH)4]-+H+ =Al(OH)3 ↓+H2O [或AlO2― +H+ =Al(OH)3 ↓](2分)
(2)
|
成分 |
质量 |
判断依据或计算推理过程 |
|
Al |
2.7g (1分) |
2Al +2NaOH +6H2O =Na[Al(OH)4]+3H2↑ 54g 67.2L m(Al) 3.36L m(Al)=54g×3.36L/67.2L=2.7g…(2分) |
|
(NH4)2SO4 |
6.6g(1分) |
|
|
MgCl2 |
4.75g(1分) |
|
|
FeCl2 |
0(1分) |
Fe(OH)2 在空气中会转化为红褐色Fe(OH)3,但步骤③中白色沉淀久置无明显变化(1分) |
|
AlCl3 |
0(1分) |
原固体中只含有Al 、(NH4)2SO4和MgCl2 ,三种物质的质量之和刚好等于14.05g,所以一定没有AlCl3 (2分,加着重号的为要点,每个要点1分) |
1. 某固体混合物可能由Al 、(NH4)2SO4、MgCl2 、FeCl2 、AlCl3 中的一种或几种组成,现对该混合物作如下实验,所得现象和有关数据如图所示(气体体积数据已换算成标准状况下的体积):


回答下列问题:
(1)写出反应④的离子方程式___________________________________________.
(2)填写下表中的空白。(注:若混合物中不存在该成分,则“质量”栏中填“0”;
画斜线的表格不需填写)
|
成分 |
质量 |
判断依据或计算推理过程 |
|
Al |
|
|
|
(NH4)2SO4 |
|
 |
|
MgCl2 |
|
|
|
FeCl2 |
|
|
|
AlCl3 |
|
|
6. ⑴Al2O3 + Na2CO3 2NaAlO2 +CO2↑;SiO2 +Na2CO3
2NaAlO2 +CO2↑;SiO2 +Na2CO3 Na2SiO3 + CO2↑
Na2SiO3 + CO2↑
⑵由于溶液在硅酸钠和偏铝酸钠发生水解,SiO32-+H2O HSiO3-+OH-,HSiO3-+H2O
HSiO3-+OH-,HSiO3-+H2O H2SiO3+OH-,AlO2-+H2O
H2SiO3+OH-,AlO2-+H2O Al(OH)3+OH-,降低pH值有利于平衡向正反应方向移动,当pH调到7-8时,使它们水解完全。
Al(OH)3+OH-,降低pH值有利于平衡向正反应方向移动,当pH调到7-8时,使它们水解完全。
⑶2CrO42-+2H+  Cr2O72-+H2O
Cr2O72-+H2O
⑷①当滴加最后一滴硫代硫酸钠溶液,溶液蓝色褪去
②94.08%
6. 重铬酸钾是工业生产和实验室的重要氧化剂,工业上常用铬铁矿(主要成份为FeO·Cr2O3)为原料生产,实验室模拟工业法用铬铁矿制K2Cr2O7的主要工艺如下,涉及的主要反应是:6FeO·Cr2O3+24NaOH+7KClO3 12Na2CrO4+3Fe2O3
+7KCl+12H2O,
12Na2CrO4+3Fe2O3
+7KCl+12H2O,
 试回答下列问题:
试回答下列问题:
⑴在反应器①中,有Na2CrO4生成,同时Fe2O3转变为NaFeO2,杂质SiO2、Al2O3与纯碱反应转变为可溶性盐,写出氧化铝与碳酸钠反应的化学方程式: 。
⑵操作③的目的是什么,用简要的文字说明: 。

 ⑶操作④中,酸化时,CrO42-转化为Cr2O72-,写出平衡转化的离子方程式: 。
⑶操作④中,酸化时,CrO42-转化为Cr2O72-,写出平衡转化的离子方程式: 。
⑷称取重铬酸钾试样2.5000g配成250mL溶液,取出25.00mL于碘量瓶中,加入10mL 2mol/LH2SO4和足量碘化钾(铬的还原产物为Cr3+),放于暗处5min,然后加入100mL水,加入3mL淀粉指示剂,用0.1200mol/LNa2S2O3标准溶液滴定(I2+2S2O32-=2I-+S4O62-)。
①判断达到滴定终点的依据是: ;
②若实验中共用去Na2S2O3标准溶液40.00mL,则所得产品的中重铬酸钾的纯度(设整个过程中其它杂质不参与反应) 。
5.(1)小,工业制备硫酸。 (2)MnO2 + 2Fe2+ + 4H+ = Mn2+ + 2Fe3+ + 2H2O。
使Fe2+ 转变为Fe3+,Fe3+完全沉淀的pH较低(或Fe3+更易沉淀)。
(3)与溶液中的酸反应,使溶液中的Fe3+、Al3+转化为氢氧化物沉淀。
(4)使MnCO3沉淀完全。MnCO3沉淀量少,NH4HCO3与酸反应。(或MnCO3、NH4HCO3与酸反应溶解)
 (5)节约能源、治理含SO2的工业废气等。(答对1个即可)(每空1分)
(5)节约能源、治理含SO2的工业废气等。(答对1个即可)(每空1分)
5. 碳酸锰(MnCO3)是理想的高性能强磁性材料,也是制备Mn2O3、MnO2等锰的氧化物的重要原料,广泛用于电子、化工、医药等行业。一种制备MnCO3的生产流程如下图所示。


 已知生成氢氧化物的pH和有关硫化物的Ksp如下表:
已知生成氢氧化物的pH和有关硫化物的Ksp如下表:
|
物质 |
Fe(OH)3 |
Fe(OH)2 |
Mn(OH)2 |
|
开始沉淀pH |
2.7 |
7.6 |
8.3 |
|
完全沉淀pH |
3.7 |
9.6 |
9.8 |
|
物质 |
MnS |
CuS |
PbS |
|
Ksp |
2.5×10-13 |
6.3×10-36 |
8.0×10-28 |
软锰矿主要成分为MnO2,其中含有铁、铝、硅的氧化物和少量重金属化合物杂质,SO2来自工业废气。流程①中主要发生的反应有:MnO2+SO2====MnSO4 2Fe3++SO2+2H2O====2Fe2++SO42-+4H+。
(1)流程①中所得MnSO4溶液的pH比软锰矿浆的pH (填“大”或“小”),该流程可与 (填写工业生产名称)联合,生产效益更高。
(2)反应②的目的是将溶液中的Fe2+氧化成Fe3+,其离子反应方程式为 ,这样设计的目的和原理是 。
(3)反应③中硫化钠的作用是使重金属离子转化为硫化物沉淀,碳酸钙的作用是 。
(4)反应④发生的化学反应为:MnSO4 + 2NH4HCO3 = MnCO3↓+ (NH4)2SO4 + CO2↑ + H2O。
反应中通常需加入稍过量的NH4HCO3 ,且控制溶液的pH为6.8-7.4。加入稍过量的NH4HCO3的目的是 ,溶液的pH不能过低的原因是 。
(5)软锰矿中锰的浸出有两种工艺:
工艺A:软锰矿浆与含SO2的工业废气反应
工艺B:软锰矿与煤炭粉混合,焙烧后加稀硫酸溶解。
其中工艺A的优点是 。(答对1个即可)
4. (1)不同,1 mol 二甲醚与乙醇燃烧所需要的O2、生成的CO2、H2O的量完全相同。但二甲醚与乙醇结构不同,1 mol二甲醚与乙醇中所含的化学键的数目相同,种类不同,导致化学键断裂所需能量不同。(2)3CO+3H2 = CH3OCH3+CO2 或 2CO+4H2 = CH3OCH3+H2O。 (3)①减小; ②12(x+y)。
设问方式多角度
4. 二甲醚(CH3OCH3)被称为21世纪的新型燃料,它清洁、高效,具有优良的环保性能。四川是利用天然气生产二甲醚的重要基地之一。
二甲醚(CH3OCH3)被称为21世纪的新型燃料,它清洁、高效,具有优良的环保性能。四川是利用天然气生产二甲醚的重要基地之一。
请填写下列空白:
(1)相同条件下,二甲醚与乙醇的燃烧热 (填“相同”或“不同”),理由是 。
 (2)二甲醚可由合成气(CO+H2)在一定条件下制得。用合成气制二甲醚时,还产生了一种可参与大气循环的无机化合物,该反应的化学方程式可能是:____________________________________。
(2)二甲醚可由合成气(CO+H2)在一定条件下制得。用合成气制二甲醚时,还产生了一种可参与大气循环的无机化合物,该反应的化学方程式可能是:____________________________________。
(3)制备二甲醚的合成气可由甲烷与水蒸气或二氧化碳经高温催化反应制得。合成气除制二甲醚外,还可用于冶炼金属,用它冶炼铁的生产过程可示意如下:
①在催化反应室中进行的反应均为可逆反应,增大体系的压强对甲烷转化率的影响是_________(填“增大”、“减小”或“不变”)。
②在上述炼铁过程的某时间段内,若有x m3(标准状况)的甲烷进入燃烧室中充分燃烧,还原反应室有5y kg(即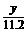 ×103 mol)铁生成,假设燃烧室与还原反应室产生的高温尾气全部进入催化反应室,则这些高温尾气在理论上可产生合成气_________m3(标准状况)。
×103 mol)铁生成,假设燃烧室与还原反应室产生的高温尾气全部进入催化反应室,则这些高温尾气在理论上可产生合成气_________m3(标准状况)。

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com