
题目列表(包括答案和解析)
9. 答案 (1)MnO2+2FeSO4+2H2SO4 MnSO4+Fe2(SO4)3+2H2O
答案 (1)MnO2+2FeSO4+2H2SO4 MnSO4+Fe2(SO4)3+2H2O
(2)Fe(OH)3、Al(OH)3
(3)Cu2+、Zn2+

 (4)MnO2+H2O+e- MnOOH+OH-(或2MnO2+H2O+2e- Mn2O3+2OH-)
(4)MnO2+H2O+e- MnOOH+OH-(或2MnO2+H2O+2e- Mn2O3+2OH-)
(5)锌、二氧化锰
[解析](1)根据FeSO4在反应条件下将MnO2还原为MnSO4,Fe2+被氧化为Fe3+,可以写其反应方程式
 2FeSO4+MnO2+2H2SO4 MnSO4+Fe2(SO4)3+2H2O。
2FeSO4+MnO2+2H2SO4 MnSO4+Fe2(SO4)3+2H2O。
(2)根据反应后滤液(Mn2+、Fe3+、Al3+、Cu2+、Zn2+、Fe2+)加氨水调pH至5.4,结合题表可知滤渣A的主要成分为Fe(OH)3和Al(OH)3。
(3)根据题表可知加入MnS是为了生成溶解度更小的CuS、ZnS而除去Cu2+、Zn2+。
(4)碱性锌锰干电池中Zn作负极,则MnO2作正极得电子。其电极反应式应为
 MnO2+H2O+e- MnOOH+OH-
MnO2+H2O+e- MnOOH+OH-
 或2MnO2+H2O+2e- Mn2O3+2OH-。
或2MnO2+H2O+2e- Mn2O3+2OH-。
(5)从碱性锌锰干电池的原料可知,其废旧电池可回收利用的物质为锌和MnO2。
8.答案 (1)炉身 炉腰
 (2)2P+5FeO+3CaO Ca3(PO4)2+5Fe 脱氧和调整钢的成分
(2)2P+5FeO+3CaO Ca3(PO4)2+5Fe 脱氧和调整钢的成分
(3)后 避免Cr被氧化(或“氧吹前加入Cr会形成炉渣被除去”)
(4)CO 燃料(或还原剂)
[解析](1)高炉炼铁,铁矿石的主要反应是在炉身部分发生,在炉腰处生成生铁和炉渣。
 (2)除钢中的磷的化学方程式为2P+5FeO+3CaO Ca3(PO4)2+5Fe,加入硅、锰和铝的目的是脱去氧和调整钢中的成分。
(2)除钢中的磷的化学方程式为2P+5FeO+3CaO Ca3(PO4)2+5Fe,加入硅、锰和铝的目的是脱去氧和调整钢中的成分。
(3)为了防止Cr元素被高温下的氧氧化,应在氧吹后加入。
(4)炼铁时用到C作燃料生成CO作还原剂,炼钢时钢中本身含有C,因此都有CO产生,而CO是有毒气体,对环境有污染,同时CO可以燃烧生成CO2。
7.答案(1)Cu、O
 (2)b、c (3)2Fe3++2I- 2Fe2++I2
(2)b、c (3)2Fe3++2I- 2Fe2++I2
 S2O
S2O +2Fe2+
2SO
+2Fe2+
2SO +2Fe3+(离子方程式不配平不扣分)
+2Fe3+(离子方程式不配平不扣分)
 (4)a.Al3++4OH- AlO
(4)a.Al3++4OH- AlO +2H2O
+2H2O
 [或Al3++4OH- Al(OH)
[或Al3++4OH- Al(OH)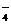 ]
]
b.稀硫酸、酸性KMnO4溶液
稀硫酸浸取炉渣所得溶液使酸性KMnO4溶液褪色
[解析](2)SO2是大气污染物,应回收利用。

 (3)因为Fe3+有氧化性,与I-发生氧化还原反应2Fe3++2I- I2+2Fe2+,生成的Fe2+具有一定的还原性,又可与S2O
(3)因为Fe3+有氧化性,与I-发生氧化还原反应2Fe3++2I- I2+2Fe2+,生成的Fe2+具有一定的还原性,又可与S2O 发生反应S2O
发生反应S2O +2Fe2+ 2SO
+2Fe2+ 2SO +2Fe3+。
+2Fe3+。
 (4)因为Al(OH)3具有两性,可以溶解在NaOH溶液中,反应式为:Al3++4OH- AlO
(4)因为Al(OH)3具有两性,可以溶解在NaOH溶液中,反应式为:Al3++4OH- AlO +2H2O。
+2H2O。
因为Fe2+有还原性,可使酸性高锰酸钾溶液褪色,因此可以用稀硫酸溶解炉渣后再在所得溶液中加入酸性高锰酸钾溶液,观察现象即可确定其中含有FeO。
6.答案(1)Cu2S (2)Cu2S和Cu2O (3)形成酸雨,会对植物和建筑物等造成严重危害 硫酸、硫酸钠
(4)以硫酸铜→硫酸溶液为电解液。电解时,粗铜(阳极)中的铜以及比铜活泼的金属失去电子进入溶液,不如铜活泼的金属沉入电解槽形成“阳极泥”;溶液中的Cu2+得到电子沉积在纯铜(阴极)上
(5)AD
 [解析](1)根据矿石的主要成分分析可知:每1 mol Cu中含有的其他元素的质量Cu2S中最小,因此Cu2S中铜的质量分数最高。
[解析](1)根据矿石的主要成分分析可知:每1 mol Cu中含有的其他元素的质量Cu2S中最小,因此Cu2S中铜的质量分数最高。
(2)根据反应方程式:
可知Cu2O和Cu2S都作氧化剂。
(3)SO2排放到大气中会造成酸雨,处理该尾气可得到有价值的化学品:H2SO4或Na2SO4。
(4)粗铜的精炼中,应将粗铜与电源的正极相连作阳极,而将纯铜与电源的负极相连作阴极,用铜盐CuSO4、CuCl2等盐溶液作电解质溶液。
(5)铜绿的成分为Cu2(OH)2CO3,能与盐酸发生反应而除去,而Cu和盐酸不反应,A正确;铜在常温下和浓H2SO4不反应,因此B中前后无因果关系,B错误;在潮湿的空气中铁和铜形成原电池,铁作负极,铜作正极,铁易生锈,因此C也不正确;CuSO4·5H2O晶体转化为CuSO4白色粉末是化学变化,CuSO4为重金属盐,可以使蛋白质变性,因此可以作为消毒剂,因此D正确。
5.答案 A
[解析]根据化学反应物质的量关系:A:1 mol Al-1 mol NaOH,B:1 mol Al(OH)3-1 mol NaOH,C:1 mol AlCl3-?4 mol NaOH,D:1 mol Al2O3-2 mol NaOH。若消耗4 mol NaOH,需要m(Al)=4 mol×27 g·mol-1=108 g,需要
m[Al(OH)3]=78 g·mol-1×4 mol=312 g,需要m(AlCl3)=1 mol×133.5 g·mol-1=133.5 g,需要m (Al2O3)=2 mol
×102 g·mol-1=204 g。由以上判断可知,相同质量时Al消耗NaOH最多。
4.答案 D
[解析]海水中氯、溴、碘、钠、镁、铝都以离子形式存在,若制取其单质,必须经过化学变化,海水提取食盐和淡水是物理变化,而由饱和食盐水制取烧碱和氢气是化学变化。
3.答案 B
2.答案 C
[解析]铝在常温下可和O2反应,A错;铝与氯气反应,B错;氧化铝是两性氧化物,既能与酸反应又能与碱反应,D错。
1.答案 D
[解析]铝与盐酸反应的速率与盐酸的浓度、铝条的表面积、溶液的温度等有关。不影响产生H2速率的因素只有D。
23.(2009宁夏卷26)碱式碳酸铜可表示为:xCuCO3·yCu(OH) 2·zH2O,测定碱式碳酸铜组成的方法有多种。
(1)现采用氢气还原法,请回答如下问题:
①写出xCuCO3·yCu(OH) 2·zH2O与氢气反应的化学方程式 ;
②试验装置用下列所有仪器连接而成,按氢气流方向的连接顺序是(填入仪器接口字母编号):
(a)→( )( )→( )( )→( )( )→( )( )→( )( )→(l)

③称取23.9g某碱式碳酸铜样品,充分反应后得到12.7g残留物,生成4.4g二氧化碳和7.2g水。该样品的结晶水质量为 g,化学式为 ;
(2)某同学以氮气代替氢气,并用上述全部或部分仪器来测定碱式碳酸铜的组成,你认为是否可行?请说明理由。 。
高考真题答案与解析
化 学
[考点15]几种重要的金属
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com