
题目列表(包括答案和解析)
4、在一定温度下。向一个容积不变的容器中,通入3 mol
SO2和2 molO2及固体催化剂,使之反应。2SO2(g)+O2(g) 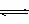 2SO3(g);△H=一196.6 kJ/mol。平衡时容器内气体压强为起始时的90%。此时
2SO3(g);△H=一196.6 kJ/mol。平衡时容器内气体压强为起始时的90%。此时
I.加入3 mol SO2和2 mol O2发生反应,达到平衡时放出的热量为 。
Ⅱ.保持同一反应温度,在相同的容器中,将起始物质的量改为a mol SO2、b mol O2、c mol SO3(g),欲使平衡时SO3的体积分数为2/9。
(1)达到平衡时,I与Ⅱ放出热量 (填序号)。
A.一定相等 B、前者一定小 C.前者大于或等于后者
(2)a、b、c必须满足的关系是(一个用a、c表示,另一个用b、f表示) 。
(3)欲使起始时反应表现为向正反应方向进行,a的取值范围是 。
答案:98.3 kJ (1)C (2)a+c=3 2b+c=4 (4)2<a≤3
练习:
3、已知:对于可逆反应:mA+n B pc+qD,在一定温度下达到化学平衡时,其平衡常数K可表示为:K=
pc+qD,在一定温度下达到化学平衡时,其平衡常数K可表示为:K=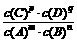 ,当反应中有固体物质参加时,分子间的碰撞只能在固体表面进行,固体物质的量浓度对反应速率和平衡没有影响,因此,固体的“浓度”作为常数,在平衡常数表达式中就不写固体浓度,如CaCOa(s)
,当反应中有固体物质参加时,分子间的碰撞只能在固体表面进行,固体物质的量浓度对反应速率和平衡没有影响,因此,固体的“浓度”作为常数,在平衡常数表达式中就不写固体浓度,如CaCOa(s)  CaO(s)+C02(g),平衡常数K=c(C02)。
CaO(s)+C02(g),平衡常数K=c(C02)。
硫化钠是一种用途广泛的化工原料,制备硫化钠的反应原理可用反应式:Na2S04(s)+4H2(g)  Na2S(s)+4H20(g)表示,已知该可逆反应在1100℃时达到平衡,并保持反应器内恒温恒容。试回答下列问题:
Na2S(s)+4H20(g)表示,已知该可逆反应在1100℃时达到平衡,并保持反应器内恒温恒容。试回答下列问题:
(1)此可逆反应的平衡常数表达式可表示为 ,温度升高后,K值会增大,意味着该反应的正方向为 反应(填“吸热”或“放热”)。
(2)下列各种情况下,平衡将发生何种变化?(填“正向”“逆向”或不”)
①加入少量Na2S04固体,平衡 移动;
②加入少量Na2SO4·10H20晶体,平衡 移动;
③加入少量灼热的焦炭,平衡 移动。
(3)若初始时加入的Na2S04是2.84 g;Na2SO4的平衡转化率为45%,则达平衡时该反应器内固体的总质量是
(注:Na2S04的转化率=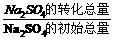 ×100%,
×100%,
(4)若将温度降低100℃,则在降温过程中对恒容反应器内气体总压强[∑p(g)]、氢气物质的量[n(H2)]、恒容反应器内气体的平均摩尔质量[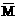 (g)]、气体的总质量(∑m(g)]的变化,描述正确的图像是 。
(g)]、气体的总质量(∑m(g)]的变化,描述正确的图像是 。
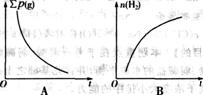
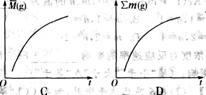
[答案](1) 吸热 (2)①不②逆向 ③正向 (3)2.264 g (4)A、B
2、 2005年是勒夏特列诞生155周年,他于1888年发现的“勒夏特列原理”,将指导我们正确地判断平衡移动的方向。现有Fe3+和I一在水溶液中如下反应:2I-+2Fe3+ 2Fe2++I2(aq)。
2Fe2++I2(aq)。
(1)当上述反应达到平衡后,加入CCl4萃取I2,且温度不变,上述平衡 移动(填“向右”“向左”或“不”)。
(2)上述反应的正向反应速率和I一、Fe3+的浓度关系为:v=Kc(I一)mc(Fe3+)n(K为常数)。
|
|
c(I一)/mol·L一1 |
c(Fe3+)/mol·L一1 |
v/mol·L-1·S-1 |
|
① |
0.20 |
O.80 |
O.032K |
|
② |
O.60 |
O.40 |
O.144K |
|
③ |
0.80 |
O.20 |
O.128K |
通过所给的数据计算得知:
在V=Kc(I一)mc(Fe3+)n中,m、n的值为 。
A.m=1,n=1 B.m=1,n=2 C.m=2,n=l D.m=2,n=2
(3)I一浓度对反应速率的影响 Fe3+浓度对反应速率的影响。(填“小于”“大于”或“等于”)
[答案](1)向右 (2)C(3)大于
6.对时间-速率图像,要注意分清曲线的连续性、跳跃性,是“渐变”还是“突变”,是“变大”还是“变小”,变化后是否仍然相等等情况,才可以确定对应改变的条件及如何改变。
典型例题
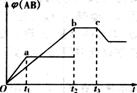 例1 反应A2+B2
例1 反应A2+B2  2AB;ΔH=Q kJ·mol-1在不同温度和压强改变条件下,产物AB的生成情况如右图所示:a为500℃.b为300℃时情况,c为300℃时从时间t3开始向容器中加压的情况。
2AB;ΔH=Q kJ·mol-1在不同温度和压强改变条件下,产物AB的生成情况如右图所示:a为500℃.b为300℃时情况,c为300℃时从时间t3开始向容器中加压的情况。
(1)下列叙述正确的是 。
A.A2、B2、AB均为气体,Q>O
B.AB为气体,A2、B2中至少有一种为非气体,Q>O
C.AB为气体,A2、B2中至少有一种为非气体,Q<O
D.AB为固体,A2、B2中至少有一种为非气体,Q<O
(2)已知Q的绝对值为200,则该反应的热化学方程式正确的是 。
A、A2(g)+B2(s)  2AB(g);ΔH=200 kJ·mol-1
2AB(g);ΔH=200 kJ·mol-1
B、A2(l)+B2(g)
 2AB(g);ΔH=一200 kJ·mol-1
2AB(g);ΔH=一200 kJ·mol-1
C、A2+B2  2AB;ΔH=一200 kJ·mol-1
2AB;ΔH=一200 kJ·mol-1
D、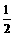 A2(g)+
A2(g)+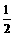 B2(s)
B2(s)  AB(g);△H=一100kJ·mol-1
AB(g);△H=一100kJ·mol-1
(3)在500℃时,在一容积固定的密闭容器中建立了上述[(2)中所选择的热化学方程式]平衡,若保持温度不变,再向容器中分别加了A2或B2或AB时,判断平衡的移动情况(填“正向”“逆向”或“不”)以及当容器中AB的体积分数不再变化时,与原平衡时比较(填“增大”减小”或“不变”)。
①加A2:平衡 移动,φ(AB) ;
②加B2:平衡 移动,φ(AB) ;
③加AB:平衡 移动,φ(AB) 。
[答案](1)C(2)D (3)①正向 减小②不不变③逆向 减小
5.运用图像中浓度(或物质的量)的变化来确定反应中化学计量数的关系,即化学计量数之比等于同一时间内各反应物、生成物的浓度(或物质的量)转化值之比。
4.掌握“先拐先平”原则,即高温高压时反应速率快,有利于先达平衡,也就是说在其他条件相同时,较高温或较高压强达到平衡所用的时间短。
3.注意曲线坡度的“平”与“陡”并弄清其意义。分清曲线函数的递增性和递减性。
2.注意曲线上的特殊点,如:曲线的起点、曲线的转折点、多条曲线的交点、曲线的终点等。
1.看清各坐标代表的量的意义,弄清曲线表示着哪些量的关系。
4.计算模式
浓度(或物质的量) aA(g)+bB(g)  cC(g)+dD(g)
cC(g)+dD(g)
起始 m n O O
转化 ax bx cx dx
平衡 m-ax n-bx cx dx
α(A)=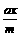 ×100%
×100%
ω(C)=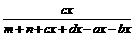 ×100%
×100%
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com