
题目列表(包括答案和解析)
2.下列各组物质中,按熔点由低到高排列正确的是( )
A. O2 、I2、 Hg B. CO2 、KCl 、SiO2
C. Na、K、 Rb D.SiC 、 NaCl 、SO2
1.下列各组物质的晶体中,化学键类型相同、晶体类型也相同的是
A. SO2和SiO2 B. CO2和H2
C. NaCl和HCl D.CCl4和KCl
7.某无色透明溶液可能含有下列离子:K+、Al3+、Fe3+、Ba2+、NO3-、SO42-、HCO3-、Cl-,取该溶液进行如下实验:
① 用蓝色石蕊试纸检测该溶液,试纸显红色;
② 取溶液少许,加入铜片和稀硫酸共热,产生无色气体,该气体遇空气立即变为红棕色;
③ 取溶液少许,加入氨水有白色沉淀生成,继续加入过量氨水,沉淀不消失;
④ 取溶液少许,滴入氯化钡溶液产生白色沉淀;
⑤ 取实验 ④ 后的澄清溶液,滴入硝酸银溶液产生白色沉淀,再加入过量的稀硝酸,沉淀不消失。
请回答下列问题:
⑴在实验 ① 中,下图所示的操作中正确的是___________(填代号)。
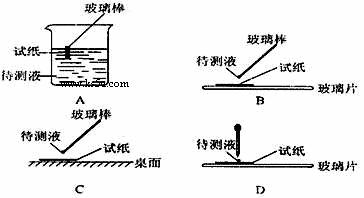
⑵根据上述实验判断原溶液中肯定存在的离子是______________________,肯定不存在的离子是______________________。
⑶写出与②③两个实验有关的离子方程式:
②_____________________________________________________________
③_____________________________________________________________
6. 向含有0.2 mol氢氧化钠和0.1 mol氢氧化钙的溶液中,持续稳定地通入二氧化碳气体,通入气体为6.72 L(标准状况)时,立即停止,则这一过程中,溶液中离子数目与通入二氧化碳气体体积的关系正确的是(不考虑气体的溶解)
向含有0.2 mol氢氧化钠和0.1 mol氢氧化钙的溶液中,持续稳定地通入二氧化碳气体,通入气体为6.72 L(标准状况)时,立即停止,则这一过程中,溶液中离子数目与通入二氧化碳气体体积的关系正确的是(不考虑气体的溶解)
5.某溶液中含有NO3-、SiO32-、AlO2-、S2-等4种离子,若向其中加入过量的盐酸溶液,微热并搅拌,再加入过量的氢氧化钠溶液,则溶液中离子数目大量减少的是
A.只有S2- B.S2-和NO3-
C.SiO32-、S2-和NO3- D.四种离子都减少
4.(08江苏卷)下列文字表述与反应方程式对应且正确的是( )
A.溴乙烷中滴入AgNO3溶液检验其中的溴元素:Br-+Ag+==AgBr↓
B.用醋酸除去水垢:CaCO3 + 2H+==Ca2+ + H2O + CO2↑
C.利用腐蚀法制作印刷线路板:Fe3+ + Cu == Fe2+ + Cu2+
D.实验室用液溴和苯在催化剂作用下制溴苯: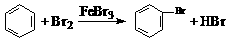
3.(08海南卷)在pH=13的无色溶液中,可以大量共存的一组离子是( )
A.NH4+、NO3- 、K+、SO42-
B.CO32_、NO3-、HCO3-、Na+
C.Na+、ClO-、AlO2-、NO3-
D.CrO42-、K+、Na+、SO42-
2.在一无色未知液中已检出有Al3+存在,在此溶液中能大量共存的离子组是
A.Na+、NH4+、NO3-、Cl- B.K+、Na+、HCO3-、Br-
C.Na+、H+、NO3-、S- D. K+、Fe2+、NO3-、Cl-
1.下列离子方程式错误的是
A.硫化钠溶液中加生产方式足量盐酸:S2-+2H+→H2S↑
B.向碳酸氢钙溶液中开始滴入氢氧化钠溶液:
Ca2++2HCO3-+2OH-→CaCO3↓+2H2O+CO32-
C.用硫酸铜溶液吸收硫化氢气体:Cu2++H2S→CuS↓+2H+
D.向浓氨水中开始滴入硫酸铝溶液:
A13++3NH3+H2O→A1(OH)3↓+3NH4+
6. 将30.0 gFe粉(过量)与50.0 mL浓硫酸在加热条件下充分反应,共收集到11.2 L(标况)气体(设生成的气体全部逸出),其质量为19.6 g。试计算:
⑴浓H2SO4的物质的量浓度
⑵反应后剩余铁粉的质量
⑶判断反应后的所得溶液能否与氯气反应?如能,请写出反应的离子方程式并计算所需氯气的物质的量;如不能,请说明理由。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com