
题目列表(包括答案和解析)
21. (11 分 )金属 (M)
的腐蚀是因为发生反应: M-ne-→Mn+。金属腐蚀造成很大的经济损失,甚至超过自然灾害,其中钢铁锈蚀最为严重,寻求防止钢铁腐蚀的方法意义重大。
(11 分 )金属 (M)
的腐蚀是因为发生反应: M-ne-→Mn+。金属腐蚀造成很大的经济损失,甚至超过自然灾害,其中钢铁锈蚀最为严重,寻求防止钢铁腐蚀的方法意义重大。
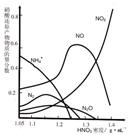
(1)一种钢铁防腐的方法是将钢铁放在冷的浓硝酸中浸泡。
但是加热或在稀 HNO3中,铁与硝酸会不断反应。不
同浓度的 HNO3 与铁反应的还原产物很复杂,其分布
曲线如图。钢铁在冷的浓硝酸中浸泡能防腐的原因是:
。
(2)工业上一般不用冷浓硝酸进行铁表面处理,其可能的原因是: 。
(3)由图示可知,密度等于1.35 g·mL-1的硝酸与铁反应时,其还原产物主要是 ;足量的铁与一定量的浓硝酸反应时,反应过程中可能的气体产物有 ;还原产物中NH4+的物质的量分数随 而增大;请用一句话概括该图反映出的基本结论: 。
(4)m mol 铁与极大量的密度为1.35 g·mL-1的硝酸溶液完全反应放出n L气体(体积在标准状况下测定),此时溶液中Fe元素的存在方式是 , n 的值最接近 (填字母编号)。
A.22.4m B.33.6m C.44.8m D.67.2m
20.(10分) 一种可再生环保型塑料CTE,它结构简式为:
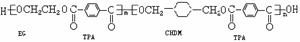
已知:(1)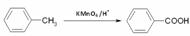
(2)RCOOR1 + R2OH → RCOOR2 + R1OH(R、R1、R2代表烃基)
这种材料可采用下列合成路线:
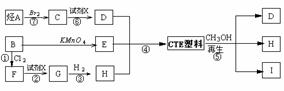
试回答下列:
(1)反应②⑥加入的试剂X是 ;⑤的反应类型是 ;
(2)写出B的结构简式: ,I的名称 ;
(3)合成时应控制的单体的物质的量
n(D)∶n(E)∶ n(H)= ∶ ∶ (用m、n表示);(4)写出化学方程式:反应 ③ ;反应 ⑥ 。
19.(8分)中学化学中几种常见物质转化关系如下:
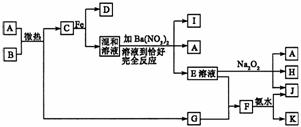
其中I是一种不溶于稀HNO3的白色沉淀,J是一种红褐色沉淀,D和H在常温常压下是无色无味气体。
(1)写出I、D的化学式.I_____;D_____;
(2)写出下列反应的化学方程式:①A+B→C+G:______;②F+氨水→J+K:_______
(3)写出鉴定K中阳离子的实验方法和现象:_______
18.(8分)现有A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,A、D同主族,C与E同主族,D、E、F同周期,A、B的最外层电子数之和与C的最外层电子数相等, A能分别与B、C形成电子总数相等的分子,且A与C形成的化合物常温下为液态,A能分别与E、F形成电子总数相等的气体分子。
请回答下列问题(题中的字母只代表元素代号,与实际元素符号无关):
(1) A-F六种元素原子,原子半径最大的是 (填序号);(2)A、C、D三种元素组成的一种常见化合物,是重要的工业产品,该化合物电子式为: ;(3)B与F两种元素形成的一种化合物分子,各原子均达八电子结构,其中B显负价,F显正价,则该化合物水解的主要产物是: ;(4)A、C、E三种元素形成的一种常见化合物,其浓溶液在加热条件下可与铜反应,该反应的化学方程式为: 。
17.(10分)
(1)在一定条件下,氢气与氮气混合发生反应,下列有关说法正确的是 (填写编号,多选扣分)①因为增大压强,反应速率加快,平衡正向移动,所以在工业生产中压强越大越好;②降低温度,平衡正向移动,但是反应速率减慢,所以在工业生产中温度越低越好;③使用铁触媒可以大大加快反应速率;④将氨变成液体,及时从平衡混合气中分离出去,可以使平衡正向移动;⑤增加氮气的浓度,可以提高氢气的转化率,但氮气的转化率会降低;⑥可以选用的催化剂很多,且催化剂可以提高平衡转化率。
(2)在一个体积为1L的密闭容器中,充入1molA和3molB,发生如下反应:A(g)+3B(g)?xC(g),平衡后,C的体积分数为W%;维持容器容积和温度不变,充入0.3molA、0.9molB和1.4molC为起始物质,达到平衡后,C的体积分数也为W%,则x可能的值为 。
平衡后若缩小容器体积,达到新平衡后,与原平衡相比较,C的浓度 (填“增大”、“减小”或“不变”,下同),C的体积分数 ,正反应速率 。
16.(11分).高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。其生产工艺如下:
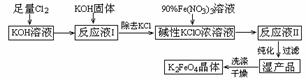
已知:① 2KOH + Cl2 → KCl + KClO + H2O(条件:温度较低);
② 6KOH + 3Cl2 → 5KCl + KClO3 + 3H2O(条件:温度较高);
③ 2Fe(NO3)3 + 2KClO + 10KOH → 2K2FeO4 + 6KNO3 + 3KCl + 5H2O回答下列问题:
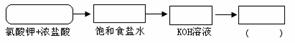
(1)该生产工艺应在 (填“温度较高”或“温度较低”)的情况下进行;(2)某同学在实验室里从下图中选择四个装置(a、b、c、d、e、f可以重复使用,也可不用)设计方案完成“足量氯气与KOH溶液”反应。已知:常温下,KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O
将所选择装置的选项字母填入方框,并在括号中写出装置内所放入的化学药品。

(3)配制KOH溶液时,是在每100 mL水中溶解61.6 g KOH固体(该溶液的密度为1.47 g/mL),它的物质的量浓度为 ;(4)在“反应液I”中加KOH固体的目的是 :
A.与“反应液I”中过量的Cl2继续反应,生成更多的KClO
B.KOH固体溶解时会放出较多的热量,有利于提高反应速率
C.为下一步反应提供反应物
D.使副产物KClO3转化为 KClO
15.用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,向所得的溶液中加入0.1mol Cu2 (OH)2CO3后恰好恢复到电解前的浓度和pH值(不考虑二氧化碳的溶解)。则电解过程中共转移的电子数为 ( )
A.0.4mol B.0.5mol C.0.6mol D.0.8mol
第II卷(非选择题 共58分)
14.在一个容积固定不变的密闭容器中进行反应:2X(g)+Y(g) 2Z(g)+W(s),已知将2molX和1 molY充入该容器中,反应在某温度下达到平衡时,Z的物质的量为p mol。下列说法中正确的是 ( )
2Z(g)+W(s),已知将2molX和1 molY充入该容器中,反应在某温度下达到平衡时,Z的物质的量为p mol。下列说法中正确的是 ( )
A.若把2molX和1 molY充入该容器时,处于状态Ⅰ,达到平衡时处于状态Ⅱ(如图1所示),则该反应的正反应是吸热反应
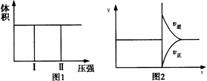 B.若降低原平衡体系温度,当再次达到平衡后,
B.若降低原平衡体系温度,当再次达到平衡后,
测得两次平衡条件下混合气体的密度未发生改变
C.反应达到平衡后,再将2molX和1 molY充入该
容器中,则反应速率V与时间t关系图如图2所示
D.若维持该题条件不变,仅从生成物开始配比,要求达
到平衡时,Z的物质的量仍为w mol则w的起始物质的量n(w)应满足的条件是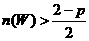 mol
mol
13.下列叙述不正确的是 ( )
A.0.1mol·L-1氨水中,c(OH-)=c(NH4+)
B.在常温下,10 mL 0.02mol·L-1HCl溶液与10 mL 0.02mol·L-1Ba(OH)2溶液充分混合,若混合后溶液的体积为20 mL,则溶液的pH=12
C.在0.1mol·L-1CH3COONa溶液中,c(OH-)=c(CH3COOH)+c(H+)
D.0.1mol·L-1某二元弱酸强碱盐NaHA溶液中,c(Na+)=c(A2-)+c(HA-)+c(H2A)
12.下列说法正确的是 ( )
A.某温度下测得纯水的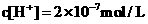 ,则其中的
,则其中的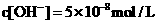
B.制备Fe(OH)3胶体,通常是将Fe(OH) 3固体溶于热水中
C.氢氟酸(HF)能腐蚀玻璃,是因为它的酸性很强。
D.氯化铝熔沸点较低,且熔融状态下不能导电,可推知氯化铝为分子晶体.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com