
题目列表(包括答案和解析)
1、(09年天津理综·9)(18分)海水是巨大的资源宝库,在海水淡化及综合利用方面,天津市位居全国前列。从海水中提取食盐和溴的过程如下:
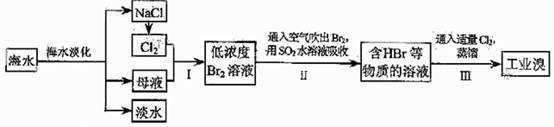
(1)请列举海水淡化的两种方法: 、 。
(2)将NaCl溶液进行电解,在电解槽中可直接得到的产品有H2、 、 、或H2、 。
(3)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br,其目的为 。
(4)步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,有关反应的离子方程式为 ,由此反应可知,除环境保护外,在工业生产中应解决的主要问题是 。
(5)某化学研究性学习小组为了解从工业溴中提纯溴的方法,查阅了有关资料,Br2的沸点为59℃。微溶于水,有毒性和强腐蚀性。他们参观生产过程后,了如下装置简图:
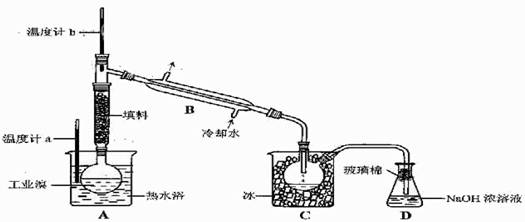
请你参与分析讨论:
①图中仪器B的名称: 。
②整套实验装置中仪器连接均不能用橡胶塞和橡胶管,其原因是 。
③实验装置气密性良好,要达到提纯溴的目的,操作中如何控制关键条件: 。
④C中液体产生颜色为 。为除去该产物中仍残留的少量Cl2,可向其中加入NaBr溶液,充分反应后,再进行的分离操作是 。
解析:(1)常规识记问题;(2)根据2NaCl+2H2O=2NaOH+H2↑+Cl2↑,以及Cl2+2NaOH= NaCl+ NaClO+ H2O可得到答案。(3)根据框图可知先前得到的溴浓度较低,这样做是使溴富集。(4)Br2+SO2+2H2O=4H++SO42-+2Br-,反应产生大量的酸,问题就出在此,会腐蚀设备。(5)只要掌握蒸馏的知识,此问应该不会出问题。
点评:本题注重理论和生产生活的实际结合,起点高,但题目平易近人。
答案:(1)蒸馏法、电渗析法、离子交换法及其其他合理答案中的任意两种
(2)Cl2 NaOH NaClO
(3)富集溴元素
(4)Br2+SO2+2H2O=4H++SO42-+2Br- 强酸对设备的严重腐蚀
(5)①冷凝管 ②Br2腐蚀橡胶③控制温度计b的温度,并收集59℃的馏分④深红棕色 分液(或蒸馏)
23、现有3个体积相等的密闭容器,都进行下列反应:CO2(g) + H2(g) H2O(g) + CO(g),反应所处的温度相同,但起始浓度不同,其中
H2O(g) + CO(g),反应所处的温度相同,但起始浓度不同,其中
甲:n(CO2) = n(H2) = 1 mol;
乙:n(CO2)=1 mol, n(H2)= 2 mol;
丙:n(CO2) = n(H2)=1mol n[H2,O(g)]=1 mol.
达到平衡时CO的物质的量由大到小的顺序是( )
A、乙>甲>丙 B、甲>丙>乙 C、乙>丙>甲 D、甲>乙>丙
22、在一定体积的密闭容器中放入3升气体R和5升气体Q,在一定条件下发生反应:2R(气)+5Q(气) 4X(气)+nY(气)。反应完全后,容器温度不变,混和气体的压强是原来的87.5%,则化学方程式中的n值是( ) A、2
B、3 C、4 D、5
4X(气)+nY(气)。反应完全后,容器温度不变,混和气体的压强是原来的87.5%,则化学方程式中的n值是( ) A、2
B、3 C、4 D、5
21、将气体A2和B2等物质的量注入容积为1L的密闭容器中反应生成C,平衡时测得c(A2)=0.58mol/L,则c(B2)=0.16mol/L,c(C)=0.84mol/L,则C的化学式为( )
A.AB2 B.A2B4 C.AB D.A2B
20、下列事实不能用平衡移动原理解释的是( )
A.加入催化剂有利于氨的合成
B、二氧化硫转化为三氧化硫时增加空气的量以提高二氧化硫的转化率
C.用排饱和食盐水法收集Cl2
D.工业制取金属钾 Na(l)+ KCl(l) 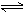 NaCl(l)+ K(g)选取适宜的温度,使K成蒸气从反应混合物中分离出来
NaCl(l)+ K(g)选取适宜的温度,使K成蒸气从反应混合物中分离出来
19、在一密闭容器中,反应 aA(气) bB(气)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则错误的看法是( )
bB(气)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则错误的看法是( )
A、平衡向正反应方向移动了 B、物质A的转化率增大
C、 物质B的质量分数增加了 D、 a>b
18、某温度下在密闭容器中发生如下反应:2M(g)+N(g) 2E(g)若开始时只充入2mol
E(g),达平衡时,混合气体的压强比起始时增大了20%;若开始时只充入2mol M和1mol N 的混合气体达平衡时M的转化率为(
)
2E(g)若开始时只充入2mol
E(g),达平衡时,混合气体的压强比起始时增大了20%;若开始时只充入2mol M和1mol N 的混合气体达平衡时M的转化率为(
)
A.20% B.40% C.60% D.80%
17、在体积可变的密闭容器中,反应mA(气)+nB(固) pC(气)达到平衡后,压缩容器的体积,发现A的转化率随之降低。下列说法中,正确的是( )
pC(气)达到平衡后,压缩容器的体积,发现A的转化率随之降低。下列说法中,正确的是( )
A.(m+n)必定小于p B.(m+n)必定大于p
C.m必定小于p D.n必定大于p
16、已知反应A2(g)+2B2(g) 2AB2(g)的△H<0,下列说法正确的是( )
2AB2(g)的△H<0,下列说法正确的是( )
A.升高温度,正向反应速率增加,逆向反应速率减小
B.升高温度有利于反应速率增加,从而缩短达到平衡的时间
C.到平衡后,升高温度或增大压强都有利于该反应平衡正向移动
D.达到平衡后,降低温度或减小压强都有利于该反应平衡正向移动
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com