
题目列表(包括答案和解析)
1.在3S + 6KOH = 2K2S + K2SO3 + 3H2O反应中,作氧化剂的S原子与作还原剂的S原子的物质的量之比是
A.1∶2 B.2∶1 C.1∶3 D.3∶1
33.(15分) 对氨基苯甲酸甲酯是一种染料中间体,用对硝基甲苯为主要起始原料经下列反应制得:
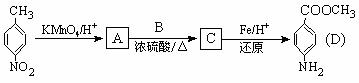
请回答下列问题:
(1)写出A、B、C的结构简式:A ,B ,C 。
(2)A C的反应类型是 : 。
C的反应类型是 : 。
(3)用核磁共振氢谱可以证明化合物C中含有 种氢处于不同的化学环境。
(4)写出同时符合下列要求:①为1,4-二取代苯,其中苯环上的一个取代基是硝基;②分子中含有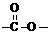 结构的基团的C的所有同分异构体的结构简式:
。
结构的基团的C的所有同分异构体的结构简式:
。
(5)C的同分异构体中有一种在酸性条件下水解后得到的一种产物能与FeCl3溶液发生显色反
应,写出该水解反应的化学方程式 。
(6)D的水解反应如下:
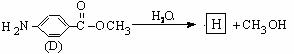
化合物H经聚合反应可制得高分子纤维,广泛用于通讯、导弹、宇航等领域。
请写出该聚合反应的化学方程式 。
广东省北师大(珠海)附中2010届高三化学二轮复习
32.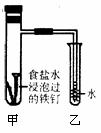 (16分)铁及其化合物在日常生活应用广泛,请根据下列实验回答问题:
(16分)铁及其化合物在日常生活应用广泛,请根据下列实验回答问题:
(1)钢铁的腐蚀
钢铁在潮湿的空气中被腐蚀的负极反应式为: ;将经过酸洗除锈的铁钉,用饱和食盐水浸泡后,放入如下图所示装置中,下列叙述正确的是
A.过一段时间,乙试管中的导管内水柱上升
B.甲试管中铁钉发生了化学腐蚀
C.铁钉在该装置中被腐蚀的情况随时间的延长而加快
(2)生铁中含有一种铁碳化合物X( Fe3C)。 X在足量的空气中高温煅烧,生成有磁性的固体Y,将Y溶于过量盐酸的溶液中含有的大量阳离子是: ;X与过量浓硝酸反应后溶液中含有的盐的化学式 。
(3)氧化铁是重要的工业颜料,用废铁屑制备它的流程如下:
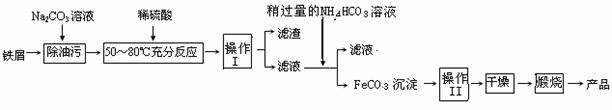
回答下列问题:
①操作Ⅰ的名称是 ,操作Ⅱ的名称是 ;
②Na2CO3溶液可以除油污,原因是(用离子方程式表示) ;
 ③请完成生成FeCO3沉淀的离子方程式:Fe2+ +
HCO3- FeCO3↓+ + H2O
③请完成生成FeCO3沉淀的离子方程式:Fe2+ +
HCO3- FeCO3↓+ + H2O
④写出在空气中煅烧FeCO3的化学方程式 ;
31.(16分)25℃时,在体积为2L的密闭容器中,气态物质A、B、C的物质的量n(mol)随时间t的变化如下图所示。已知达平衡后,降低温度,A的转化率将增大。

(1)根据上图数据,写出该反应的化学方程式____________________;此反应的平衡常数表达式K= 。从反应开始到达第一次平衡时的平均速率v(A)为 。
(2) 在5~7min内,若K值不变,则此处曲线变化的原因是 。
(3)下图表示此反应的反应速率v和时间t的关系图
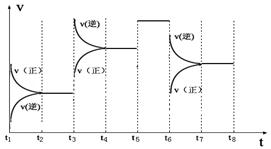
各阶段的平衡常数如下表所示:
|
t2 ~ t3 |
t4 ~ t5 |
t5 ~ t6 |
t7 ~ t8 |
|
K1 |
K2 |
K3 |
K4 |
根据上图判断,在t3和t6时刻改变的外界条件分别是_____________和______________;K1、K2、K3、K4之间的关系为: (用“>”、“<”或“=”连接)。A的转化率最大的一段时间是 。
30.(17分)粗盐提纯的研究。
[有关资料] (Ksp为物质的溶度积常数,其值愈小表示其溶解度愈小)
|
化学式 |
CaCO3 |
CaSO3 |
CaC2O4 |
Mg(OH)2 |
|
Ksp |
4.96×10-9 |
4.96×10-9 |
2.34×10-9 |
5.61×10-12 |
某研究性学习小组对粗盐的提纯和检验进行研究,并提出一些新的方案。已知该粗盐样品中主要含有不溶性杂质、Mg2+、Ca2+等(忽略SO42-的存在),该小组设计流程如下:

[设计除杂过程]
(1)操作①中需要使用玻璃棒,其作用是 。操作②的名称为 ,若在操作②结束后发现溶液B略有浑浊,应采取的措施是_______ _______________ 。
(2)混合液A的主要成分是NaOH和Na2CO3,则反应的离子方程式有______ 。
[检验除杂效果]
(3)为检验溶液B中Mg2+、Ca2+是否除尽,通常分别取少量溶液B于两支试管中,进行如下实验:
步骤一:检验Mg2+是否除尽。向其中一支试管中加入 溶液(填化学式),看是否有沉淀生成。
步骤二:检验Ca2+是否除尽。向另一支试管中加入某溶液,看是否有沉淀生成。效果最好的是 (填字母)。
a.Na2CO3 b.Na2SO3 c.Na2C2O4
[获取纯净食盐]
(4)对溶液B加热并不断滴加6 mol·L-1的盐酸溶液,同时用pH试纸检测溶液,直至pH=7时停止加盐酸,得到溶液C。该操作的目的是 。
(5)将溶液C倒入蒸发皿中,加热蒸发并用玻璃棒不断搅拌,直到 _ _____________时(填现象),停止加热。
[问题讨论]
(6)在除杂过程中,向粗盐悬浊液中加混合液A时需要加热,目的是 。
a.加快沉淀生成 b.增加沉淀溶解量 c.使沉淀分解
23.下列叙述正确的是
A.氯水中:c(Cl-)>c(H+)>c(OH-)>c(ClO-)
B.0.1mol·L-1NaHCO3溶液:c(Na+)>c(HCO3-)>c(OH-)>c(H+)
C.物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合:
c(H+) + c(Na+) = c(CH3COO-) +c(OH-)
D.pH=3的醋酸溶液与pH=11的氢氧化钠溶液等体积混合后,溶液的pH=7
22.已知反应:①101kPa时,2C(s)+O2(g)=2CO(g);△H=-221kJ/mol
②稀溶液中,H+(aq)+OH-(aq)=H2O(1);△H=-57.3kJ/mol
③H2(g) + 1/2O2(g) = H2O(g);△H= -241.8 kJ/mol
④H2O(g)= H2O(l) ;△H= -44.0 kJ/mol
下列结论正确的是
A.碳的燃烧热大于110.5kJ/mol
B. 浓硫酸与稀NaOH溶液反应生成1mol水,放出57.3kJ热量
C.氢气的燃烧热为241.8 kJ/mol
D.2H2(g) + O2(g) = 2H2O(l)的反应热为△H= -571.6 kJ/mol
12.下列实验事实与所得出的相应结论不相符的是 ( )
|
|
实 验 事 实 |
结 论 |
|
A |
氯气通入淀粉碘化钾溶液中,溶液变蓝 |
氧化性:Cl2>I2 |
|
B |
高压钠灯发出透雾性强的光 |
金属钠具有强还原性 |
|
C |
将CO2通入苯酚钠溶液中,出现白色浑浊 |
酸性:碳酸>苯酚 |
|
D |
某无色溶液中加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝 |
该溶液一定有NH4+ |
11.下列说法正确的是
( )
A.向盐酸中滴加氨水的离子方程式:H++OH-=H2O
B.强碱性溶液中大量存在:K+、Al3+、Cl-、SO42-
C.原电池的外电路中,电子由正极流向负极
D.电解池的内电路中,阳离子向阴极移动
10.下列说法不正确的是 ( )
A.珠江入海口三角洲的形成通常与胶体的性质有关
B.高纯度的硅单质广泛用于制作光导纤维
C.四川灾区重建使用了大量钢材,钢材是合金
D.常用的自来水消毒剂有氯气和二氧化氯,两者都含有共价键
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com