
题目列表(包括答案和解析)
3.能够充分说明在恒温下的密闭容器中反应:2SO2+O2 2SO3,已经达到平衡的标志是( )
2SO3,已经达到平衡的标志是( )
A.容器中SO2、O2、SO3共存 B.容器中SO2和SO3的浓度相同
C.容器中SO2、O2、SO3的物质的量为2︰1︰2 D.容器中压强不随时间的变化而改变
2.在m A(g) + n B(g)  p C(g) + q D(g)的反应中,(m.n.p为各物质的化学计量数),经5min达到平衡,测得:A增加3 mol·L-1,B增加1 mol·L-1,C减少2
mol·L-1,此时若给体系加压,平衡不移动,则m :n
:p :q为( )
p C(g) + q D(g)的反应中,(m.n.p为各物质的化学计量数),经5min达到平衡,测得:A增加3 mol·L-1,B增加1 mol·L-1,C减少2
mol·L-1,此时若给体系加压,平衡不移动,则m :n
:p :q为( )
A.2 :3 :2 : 3 B.2 :2 :3 : 3
C.3 :1 :2 : 2 D.3 :1 :2 : 3
1.在不同条件下,分别测得反应2SO2+O2  2SO3的速率如下,其中最快的是( )
2SO3的速率如下,其中最快的是( )
A.v(SO3) = 4 mol·L-1·min-1 B.v(O2) = 2 mol·L-1·min-1
C.v(SO2) = 5 mol·L-1·min-1 D.v(SO2) = 0.1 mol·L-1·S-1
3. 水垢可以看作由多种物质组成的混合物,为研究含有Ca2+、Mg2+、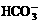 的水所形成的水垢的化学组成,取干燥的水垢6.32 g ,加热使其失去结晶水,得到5.78 g 剩余固体A;高温灼烧A至恒重,残余固体为CaO和MgO,放出的气体用过量的Ba(OH)2溶液吸收,得到的11.82 g沉淀。
的水所形成的水垢的化学组成,取干燥的水垢6.32 g ,加热使其失去结晶水,得到5.78 g 剩余固体A;高温灼烧A至恒重,残余固体为CaO和MgO,放出的气体用过量的Ba(OH)2溶液吸收,得到的11.82 g沉淀。
(1)通过计算确定A中是否含有碳酸镁;
(2)5.78 g剩余固体A灼烧至恒重时产生的气体完全被碱石灰吸收,碱石灰增重2.82 g,通过计算确定A中各成分的物质的量,并计算出水垢中碳酸盐质量分数。
2. 较低温度下,氯气通入石灰乳中可制得漂白粉,该反应为放热反应。某校甲、乙两化学研究性学习小组均用200 mL 12 mol / L盐酸与17.4 g MnO2在加热条件下反应制备氯气,并将制备的氯气与过量的石灰乳反应制取漂白粉,用稀氢氧化钠溶液吸收残余的氯气。分析实验结果发现:① 甲、乙两组制得的漂白粉中Ca(ClO)2的质量明显小于理论值,② 甲组在较高温度下将氯气与过量的石灰乳反应,所制得的产品中Ca(ClO3)2的含量较高。试回答下列问题:
(1)上述实验中理论上最多可制得Ca(ClO)2多少克?
(2)实验中所得到的Ca(ClO)2的质量明显小于理论值,试简要分析其可能原因,并写出可能涉及到的化学方程式。
1. 将3.20g Cu溶于B mol/L过量的硝酸溶液30.0 mL中,假设硝酸的还原产物只有NO2和NO,反应结束后,将所剩溶液加水稀释至1000 mL,测得c(NO3-)=0.200 mol/L。
(1)试求稀释后溶液的pH。
(2)生成的气体中NO2和NO的物质的量(可以含有B的代数式表示)。
(3)用NaOH溶液吸收氮的氧化物是防止NOx污染的一种方法。原理为:
2NO2+2NaOH=NaNO3+NaNO2+H2O,NO+NO2+2NaOH=2NaNO2+H2O
若生成的混合气体能被NaOH溶液完全吸收,试讨论B的取值范围。
4.硫酸工业在国民经济中占有极其重要的地位。
(1)硫酸的最大消费渠道是化肥工业,用硫酸制造的常见化肥有 (任写一种)。
(2)硫酸生产中,根据化学平衡原理来确定的条件或措施有 (填写序号)。
A.矿石加入沸腾炉之前先粉碎 B.使用V2O5作催化剂
C.转化器中使用适宜的温度 D.净化后的炉气中要有过量的空气
E.催化氧化在常压下进行 F.吸收塔中用98.3%的浓硫酸吸收SO3
(3)在硫酸工业中,通过下列反应使二氧化硫转化为三氧化硫:
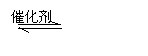
2SO2(g)+O2(g) 2SO3(g) △H=-98.3kJ·mol-1
在实际工业生产中,常采用“二转二吸法”,即将第一次转化生成的SO2分离后,将未转化的SO2进行二次转化,假若两次SO2的转化率均为95%,则最终SO2的转化率为 。
(4)硫酸的工业制法过程涉及三个主要的化学反应及相应的设备(沸腾炉、转化器、吸收塔)。
①三个设备分别使反应物之间或冷热气体间进行了“对流”。请简单描述吸收塔中反应物之间是怎样对流的。
。
②工业生产中常用氨-酸法进行尾气脱硫,以达到消除污染、废物利用的目的。用化学方程式表示其反应原理。(只写出2个方程式即可)
。
3. 纯碱是一种重要的化工原料。目前制碱工业主要有“氨碱法”和“联合制碱法”两种工艺,请按要求回答问题:
(1)“氨碱法”产生大量CaC12废弃物,请写出该工艺中产生CaC12的化学方程式:
;
(2)写出“联合制碱法”有关反应的化验学方程式:
; 。
(3)CO2是制碱工业的重要原料,“联合制碱法”与“氨碱法”中CO2的来源有何不同?
;
(4)绿色化学的重要原则之一是提高反应的原子利用率。根据“联合制碱法”总反应,列出计算原子利用率的表达式:
原子利用率(%)= 。
2. 聚合氯化铝晶体的化学式为[Al2(OH)nCl6-n·XH2O]m,它是一种高效无机水处理剂,它的制备原理是调节增大AlCl3溶液的pH,通过促进其水解而结晶析出。其制备原料主要是铝加工行业的废渣--铝灰,它主要含Al2O3、Al,还有SiO2等杂质。聚合氯化铝生产的工艺流程如下:
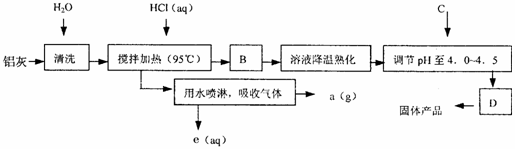
(1)搅拌加热操作过程中发生反应的离子方程式为:
; 。
(2)生产过程中B和D的操作名称分别是 和 (B和D均为简单操作)。
(3)反应中副产品a是 。
(4)生产过程中可循环使用的物质是 (用化学式表示)。
(5)调节pH至4.0~4.5的目的是 。
(6)实验室要测定水处理剂产品中n和x的值。为使测定结果更准确,需得到的晶体较纯净。生产过程C物质可选用 。
A.NaOH B.Al C.氨水 D.Al2O3 E.NaAlO2
1. 现代社会中铜在电气、交通、机械和冶金、能源及石化工业、高科技等领域有广泛的应用。某铜矿石含氧化铜、氧化亚铜、三氧化二铁和脉石(SiO2),现采用酸浸法从矿石中提取铜,其工艺流程图如下。其中铜的萃取(铜从水层进入有机层的过程)和反萃取(铜从有机层进入水层的过程)是现代湿法炼铜的重要工艺手段。
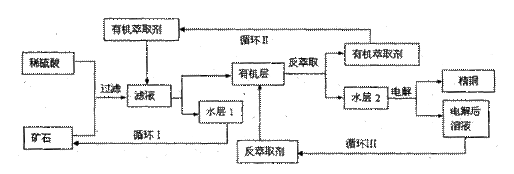
已知:①Cu+在酸性溶液中不稳定,可发生自身氧化还原反应;②当矿石中三氧化二铁含量太低时,可用硫酸和硫酸铁的混合液浸出铜;③反萃取后的水层2是硫酸铜溶液。
回答下列问题:
(1)矿石用稀硫酸处理过程中Cu2O发生反应的离子方程式为: ;
(2)“循环I”经多次循环后的水层1不能继续循环使用,但可分离出一种重要的硫酸盐晶体,该晶体的化学式是 。若水层1暴露在空气中一段时间后,可以得到另一种重要的硫酸盐,写出水层1暴露在空气中发生反应的离子方程式 。
(3)写出电解过程中阳极(惰性电极)发生反应的电极反应式: 。
(4)“循环III”中反萃取剂的主要成分是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com