
题目列表(包括答案和解析)
3、 写出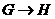 的化学方程式:______________________________
的化学方程式:______________________________
2、 写出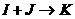 的离子方程式:___________________________
的离子方程式:___________________________
例1、有关金属元素特征的叙述正确的是:
A、 金属元素的原子只有还原性,离子只有氧化性
B、 金属元素在化合物中一定显正价
C、 金属元素在不同化合物中的化合价均相同
D、 金属元素的单质在常温下均为金属晶体
例2、粉末状试样A是由等物质的量的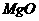 和
和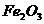 组成的混合物。
组成的混合物。
进行如下试验:
①取适量A进行铝热反应产物中有单质B生成;②另取20gA全部溶于0.15L6.0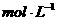 的盐酸中得溶液C;③将①中得到的单质B和溶液C反应,放出11.2L(标准状态)气体,同时生成溶液D,还残留固体物质B;④用
的盐酸中得溶液C;③将①中得到的单质B和溶液C反应,放出11.2L(标准状态)气体,同时生成溶液D,还残留固体物质B;④用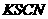 溶液检验时,溶液D不变色。
溶液检验时,溶液D不变色。
请填空:
⑴①中引发铝热反应的试验操作是___________________________,产物中单质B是_____
⑵②中发生的各反应的化学方程式是_________________________________________
⑶③中发生的各反应的离子方程式是_________________________________________
⑷若溶液D的体积仍视为0.15L,则该溶液中:
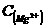 =__________,
=__________,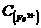 =_____________
=_____________
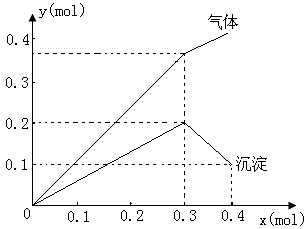 例3、有一透明溶液,
例3、有一透明溶液,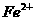 、
、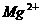 、
、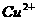 、
、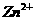 、
、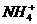 ,当加入一种淡黄色固体物质时,便有刺激性气味的混合气体放出,同时生成白色沉淀。若加入的淡黄色固体物质的量x和放出气体及产生沉淀的物质的量y,其关系如图示(
,当加入一种淡黄色固体物质时,便有刺激性气味的混合气体放出,同时生成白色沉淀。若加入的淡黄色固体物质的量x和放出气体及产生沉淀的物质的量y,其关系如图示(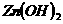 与
与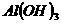 类似,也是两性氢氧化物)。试回答:
类似,也是两性氢氧化物)。试回答:
⑴淡黄色固体是__________________
⑵当淡黄色固体由0.3 到0.4
到0.4 时,其化学方程式:__________________________
时,其化学方程式:__________________________
⑶溶液中所含离子及各离子物质的量之比__________________
例4、下列物质均是中学化学常见物质,转化关系图中D为红棕色金属氧化物粉末。
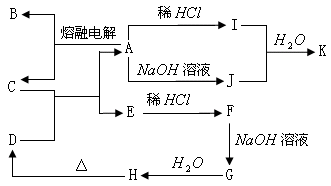
回答下列问题:
1、 写出下列物质的化学式:A________ B__________ C___________
7、金属的冶炼:
⑴原理_______________________________________
⑵方法:根据金属活动性强弱,常用以下三种方法:
A、 电解法,如:__________________________________
B、 热还原法,如:__________________________________
C、 热分解法,如:___________________________________
6、注意两个“三角”关系:
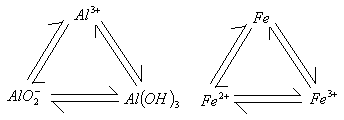
5、金属氢氧化物:
 、
、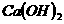 、
、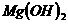 、
、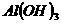 、
、 、
、 、
、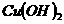
①属于强碱的是_________________________
②难溶于水的是_________________________
③受热易分解的是________________________
④易被氧化的是__________________________
⑤能经水解反应生成的是____________________
⑥和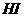 反应不能生成对应价态金属盐的是_________
反应不能生成对应价态金属盐的是_________
实验室中如何制备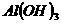 和
和 ?为什么?
?为什么?
___________________________________________________
4、金属氧化物:
金属氧化物可分为__________、__________、___________三类。
⑴碱性氧化物,如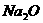 、
、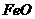 、
、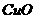 、
、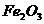 等,其性质是:
等,其性质是:
______________________________________________________
⑵两性氧化物,如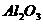 ,其性质是____________________
,其性质是____________________
⑶过氧化物,如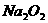 、
、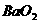 等,其晶体中存在的阳离子是_____,阴离子是___;过氧化物典型的化学性质是_____________ 原因是________________,为什么
等,其晶体中存在的阳离子是_____,阴离子是___;过氧化物典型的化学性质是_____________ 原因是________________,为什么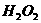 也存在此典型性质?______________________
也存在此典型性质?______________________
3、金属单质的性质:
⑴金属晶体:金属单质形成的晶体都属于金属晶体,它们由_________构成;金属晶体有_________________通性。
⑵金属单质的化学性质:
①金属在化学反应中都较容易失去电子被氧化: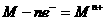 。可以根据___________判断金属单质还原性的强弱。
。可以根据___________判断金属单质还原性的强弱。
②金属单质跟酸反应的规律:
按金属活动性顺序表______________________________
A、与非氧化性酸(如盐酸、稀硫酸等)反应:
________________________能与非氧化性酸发生置换反应,实质是:
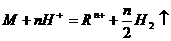
金属原子失去电子数与被还原的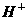 离子数、生成的
离子数、生成的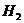 的分子数之间存在什么关系?
的分子数之间存在什么关系?
___________________________________________________
 (溶液)=_________________
(溶液)=_________________
等物质的量的金属与足量的酸反应,生成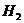 物质的量多少决定于什么?
物质的量多少决定于什么?
___________________________________________________
等质量的金属跟足量的酸反应生成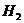 的多少应如何判断?
的多少应如何判断?
____________________________________________________
B、与强氧化性酸的反应:
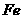 和
和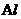 遇冷的浓硫酸、浓硝酸发生钝化反应。
遇冷的浓硫酸、浓硝酸发生钝化反应。
强氧化性酸跟金属反应不能生成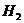 ,为什么?写出典型的几个反应:
,为什么?写出典型的几个反应:
_____________________________________________________
2、金属性强弱的判断规律:
⑴跟(或非氧化性酸)反应的剧烈程度;
⑵金属最高价氧化物对应水化物碱性的强弱;
⑶置换反应;
⑷原电池的正、负极;
⑸电解时金属阳离子的放电顺序(金属阳离子的氧化性)。
1、金属元素的原子结构特点和在周期表中的位置:
⑴结构特点:金属元素原子的最外层电子数____,原子的半径(与同周期元素相比)____
⑵位置:金属元素集中于元素周期表的______方,分布于______族和所有的_____元素族中,_____族是完全由金属元素构成的族。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com