
题目列表(包括答案和解析)
12.下列有关盐溶液的说法中,不正确的是( )
A.在溶质物质的量相等的Na2CO3、NaHCO3 两溶液中,阴离子总数相等
B.常温下,等物质的量浓度的Na2CO3溶液的pH值大于NaHCO3溶液的pH值
C.在NaHCO3溶液中一定有:c(Na+)>c(HCO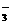 )>c(OH-)>c(H+)
)>c(OH-)>c(H+)
D.在Na2CO3溶液中一定有:c(Na+)十c(H+)=c(HCO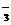 )+c(OH-)十2c(CO
)+c(OH-)十2c(CO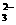 )
)
11.《新科学家》网站报道,科学家通过电解Fe2O3-SiO2-CaO的熔融液(1600℃)制得了
铁和氧气。与常规方法比,将该方法用于工业上大规模冶铁具有某些优点,以下关于这些优点分析错误的是( )
A.副产工业用氧 B.大幅度降低能耗
C.大幅度降低温室气体的排放 D.制得更纯的铁
10.常温下,c(H+)=0.1 mol·L-1的无色透明溶液中,下列各组离子一定能大量共存的( )
A.NH4+、Mg2+、SO42-、Cl- B.Mg2+、I-、NO3-、SO42-
C.K+、MnO4-、SO42-、Cl- D.Na+、K+、NO3-、CO32-
9.下列实验操作与安全事故处理均正确的是( )
①做银镜反应实验后的试管内壁附有银,可用氨水清洗 ②配制一定物质的量浓度的NaCl溶液时,只需使用1次玻璃棒 ③欲从碘水中分离出I2,可将适量的CCl4加入碘水中振荡静置分层后分液 ④将饱和氯化铁溶液煮沸,可制得氢氧化铁胶体 ⑤使用水银温度计测量烧杯中水浴温度时,不慎打破水银球,用滴管将水银吸出放入水封的小瓶中,残破的温度计插入装有硫粉的广口瓶中
⑥用试管夹从试管底由下往上夹住距试管口约1/3处,手持试管夹长柄末端,进行加热 ⑦制备乙酸乙酯时,将乙醇和乙酸依次加入到浓硫酸中 ⑧把玻璃管插入橡胶塞孔时,用厚布护手,紧握用水湿润的玻璃管插入端,缓慢旋进塞孔中
A.①②③④ B.②⑤⑥⑦ C.③⑤⑥⑧ D.⑤⑥⑦⑧
8.设NA为阿伏加德罗常数,下列叙述中正确的是( )
A.用足量NaOH溶液完全吸收1 mol Cl2时,转移电子的数目是6.02×1023
B.等物质的量的-CH3与OH-所含电子数相等
C.标准状况下,11.2 LCO2和O3混合气体中含有的原子数是1.5 NA D.常温常压下,18.0 g NH4+中所含的质子数为10 NA
7.逻辑推理是化学学习中常用的一种思维方法,以下推理中正确的是( )m
A.化合物都是由不同元素组成的,不同元素组成的物质一定是化合物
B.金属镁排在金属活动性顺序表中氢元素的前面,所以其与硝酸反应一定放出氢气
C.中和反应都有盐和水生成,有盐和水生成的反应都属于中和反应
D.氧化物中都含有氧元素,含氧元素的化合物不一定是氧化物
33.(16分)以石油裂解气为原料,通过一系列化学反应可得到重要的化工产品增塑剂G。
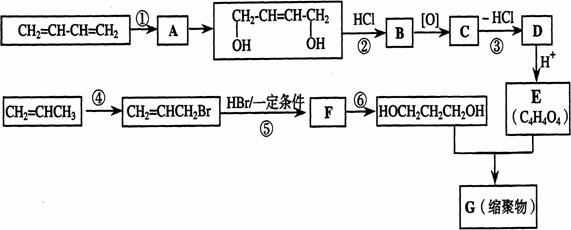
请完成下列各题:
(1)写出反应类型:反应① ,
反应④ ,
(2)写出反应条件:反应③ ,
反应⑥ ,
(3)反应②③的目的是: 。
(4)写出反应⑤的化学方程式: 。
(5)B被氧化成C的过程中会有中间产物生成,该中间产物可能是 (写出一种物质的结构简式),检验该物质存在的试剂是 。
(6)写出G的结构简式 。
32.(17分)重铬酸钾是工业生产和实验室的重要氧化剂,工业上常用铬铁矿(主要成分为FeO·Cr2O3)为原料生产,实验室模拟工业法用铬铁矿制K2Cr2O7的主要工艺如下,涉及的主要反应是:
6FeO·Cr2O3 + 24NaOH +7KClO3 12Na2CrO4
+ 3Fe2O3 +7KCl + 12H2O,
12Na2CrO4
+ 3Fe2O3 +7KCl + 12H2O,
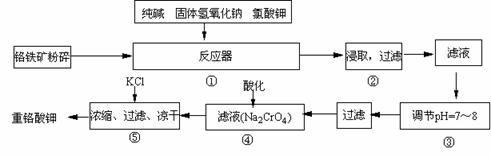
试回答下列问题:
(1)在反应器①中,有Na2CrO4生成,同时Fe2O3转变为NaFeO2,杂质SiO2、Al2O3与纯碱反应转变为可溶性盐,写出二氧化硅、氧化铝分别与碳酸钠反应的化学方程式:
;
。
(2)NaFeO2能强烈水解,在操作②生成沉淀而除去,写出该反应的化学方程式:
。
(3)操作③的目的是什么,用简要的文字和化学方程式说明:
。
(4)操作④中,酸化时,CrO42-转化为Cr2O72-,写出平衡转化的离子方程式:
。
(5)称取重铬酸钾试样2.500 g配成250 mL溶液,取出25.00 mL于碘量瓶中,加入10.00 mL 2 mol/L H2SO4和足量碘化钾(铬的还原产物为Cr3+),放于暗处5 min,然后加入100.0 mL水,加入3 mL淀粉指示剂,用0.120 0 mol/LNa2S2O3标准溶液滴定(I2+2S2O32-=2I-+S4O62-)。
①判断达到滴定终点的依据是: ;
②若实验中共用去Na2S2O3标准溶液40.00mL,则所得产品的中重铬酸钾的纯度(设整个过程中其他杂质不参与应) 。
31.(15分)
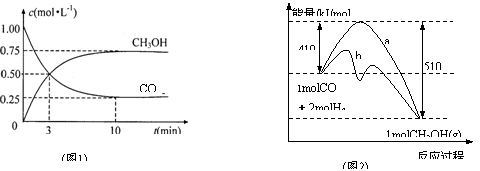 工业上用CO生产燃料甲醇。一定条件下发生反应:CO(g)+2H2(g)
工业上用CO生产燃料甲醇。一定条件下发生反应:CO(g)+2H2(g)
 CH3OH(g)。
CH3OH(g)。
(1)图1是反应时CO和CH3OH(g)的浓度随时间变化情况。从反应开始到平衡,用CO浓度变化表示平均反应速率v(CO)= ;
(2)图2表示该反应进行过程中能量的变化。曲线a表示不使用催化剂时反应的能量变化,曲线b表示使用催化剂后的能量变化。该反应是_________ (选填“吸热”或“放热”)反应,写出反应的热化学方程式 ;选择适宜的催化剂, ______(填“能”或“不能”)改变该反应的反应热;
(3)该反应平衡常数K的表达式为 ,温度升高,平衡常数K_________(填“增大”、“不变”或“减小”);
(4)恒容条件下,下列措施中能使 增大的有______。
a.升高温度; b.充入He气 c.再充入1molCO和2molH2 d.使用催化剂
30.(16分)硫酸铜是一种应用极其广泛的化工原料。以下是某工厂用含铁废铜为原料生产胆矾(CuSO4·5H2O)的生产流程示意图:


胆矾和石膏在不同温度下的溶解度(g/100g水)见下表。
|
温度(℃) |
20 |
40 |
60 |
80 |
100 |
|
石膏 |
0.32 |
0.26 |
0.15 |
0.11 |
0.07 |
|
胆矾 |
32 |
44.6 |
61.8 |
83.8 |
114 |
请回答下列问题:
(1)红棕色滤渣的主要成分是__________;
(2)写出浸出过程中生成硫酸铜的化学方程式 ;
(3)操作I的操作温度应该控制在________℃左右;
(4)从溶液中分离出硫酸铜晶体的操作II应为____________________、洗涤、干燥;
(5)取样检验是为了确认Fe3+是否除净。有同学设计了以下两种方案,在实验室分别对所取样品按下列方案进行操作:
方案一:取样于试管→滴加KSCN溶液;方案二:径向层析→喷KSCN溶液
①你认为上述两种方案设计更合理的是__________;
②指出你认为不合理的方案存在的问题_____________________________;
(6)反应产物中的NO可以循环使用,用化学方程式表示循环使用的方案
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com