
题目列表(包括答案和解析)
25.(10分)某课外研究小组,用含有较多杂质的铜粉,通过不同的化学反应制取胆矾。其设
计的实验过程为:
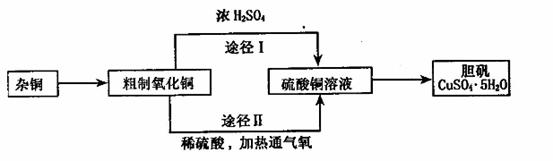
(1)铜中含有大量的有机物,可采用灼烧的方法除去有机物,灼烧时将瓷坩埚置于
上(用以下所给仪器的编号填入,下同),取用坩埚应使用 ,灼烧后的坩埚应放在
上,不能直接放在桌面上。
实验所用仪器:a.蒸发皿b.石棉网c.泥三角d.表面皿e.坩埚钳f.试管夹
(2)杂铜经灼烧后得到的产物是氧化铜及少量铜的混合物,用以制取胆矾。灼烧后含有少
量铜的可能原因是 。
A.灼烧过程中部分氧化铜被还原 B.灼烧不充分,铜未被完全氧化
C.氧化铜在加热过程中分解生成铜 D.该条件下铜无法被氧气氧化
(3)通过途径Ⅱ实现用粗制氧化铜制取胆矾,必须进行的实验操作步骤:酸溶、加热通氧气、
过滤、 、冷却结晶、 、自然干燥。
(4)由粗制氧化铜通过两种途径制取胆矾,与途径I相比,途径Ⅱ有明显的两个优点是:
、 。
(5)在测定所得胆矾(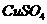 ·
·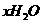 )中结晶水x值的实验过程中:称量操作至少进行
)中结晶水x值的实验过程中:称量操作至少进行
次。
(6)若测定结果x值偏高,可能的原因是 。
A.加热温度过高 B.胆矾晶体的颗粒较大
C.加热后放在空气中冷却 D.胆矾晶体部分风化


甲同学设计了以下三种探究方案:
方案I:取该红色物质溶于足量稀硝酸中,观察溶液颜色的变化。
方案Ⅱ:取该红色物质溶于足量稀硫酸中,观察现象。
方案Ⅲ:称得干燥的坩埚的质量为m1g,取红色物质置于坩埚中再称得质量为m2g。然后
将红色物质在空气中充分灼烧至完全变黑,并在干燥器中冷却,再称量,反复多次直到质
量不变,称得最后质量为m3g,比较m1、m2、m3。
回答下列问题:
(1)方案I是否合理? (填“合理”或“不合理”)。如果你认为该方案合理,请简述
其工作原理;如果你认为该方案不合理,请简述原因。 。
(2)方案Ⅱ中,若观察不到明显现象,则可知红色物质为 ;若观察到溶液变为蓝
色,则可知红色物质为 。
(3)方案Ⅲ中,如果m1、m2、m3的关系符合m3=
,可确认红色物质为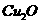
(4)乙同学利用下列装置设计了第四种探究方案:
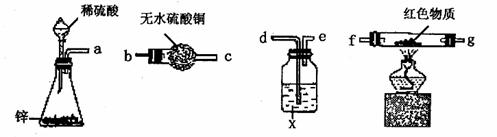
各装置接口的正确连接顺序是( )接( )( )接( )( )接( );试剂X
可选用 ;要测定红色物质的成分,最少需要测定的物理量是 (填序号)。
①通入氢气的体积 ②反应前,红色物质+反应管的总质量
③实验前干燥管的质量 ④完全反应后,红色物质+反应管的总质量
⑤反应管的质量 ⑥实验后干燥管的质量
24.(15分)用如下图所示装置可以完成一系列实验(图中夹持装置已略去)
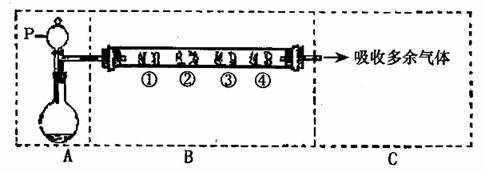
请回答下列问题:
I.(1)仪器p的名称是 ,若用装置A由浓硫酸和亚硫酸钠固体制取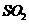 气体,并通
气体,并通
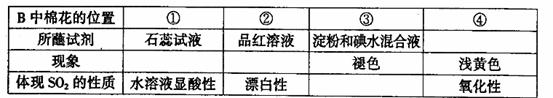
过装置B完成表中设计实验,请填写表中空白:
(2)写出③中反应的离子方程式: 。
Ⅱ.若用装置A由浓硫酸和浓盐酸混合制取HCl气体,装置B中的四处棉花依次做了如下
处理:①包有某固体物质、②蘸有KI溶液、③蘸有石蕊溶液、④蘸有浓NaOH溶液。
(1)仪器p中盛装试剂的化学式为 。
(2)反应开始后,观察到②处有棕黄色物质产生,写出②处发生反应的离子方程式:
。
①处包有的某固体物质可能是 (填序号)。
a.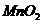 b.
b.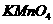 c.KCl d.Cu
c.KCl d.Cu
(3)在实验过程中,在③处能观察到 。
(4)反应较长时间后,②处有棕黄色褪去,生成无色的IO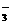 ,写出该反应的离子方程式:
,写出该反应的离子方程式:
。
(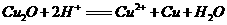 );②在空气中灼烧
);②在空气中灼烧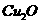 能生成CuO。
能生成CuO。
5.(18分)

 高☆考♂资♀源?网 ☆
高☆考♂资♀源?网 ☆
Ⅰ.(8分)中和热测定实验的关键是要比较准确地配制一定物质的量浓度的溶液,整套装置要尽量做到绝热;在量热的过程中要尽量避免热量的散失,比较准确地测量出反应前后溶液温度的变化。回答下列问题:
(1)中学化学实验中的中和热的测定所需的玻璃仪器除烧杯和温度计外还有______
______________。
(2)该实验常用0.50mol/L HCl和0.55mol/L的NaOH溶液各50mL进行反应。实验中,使NaOH溶液稍过量的主要原因是________________________________。
(3)若上述HCl、NaOH溶液的密度都近似为1g/cm3,若反应前后的温度分别为t1℃、t2℃,中和后生成的溶液的比热容c=4.18J/(g·℃),则该中和反应放出热量为______________kJ(填表达式),其中和热△H=______________kJ/mol(填表达式)。
Ⅱ.(10分)根据科学实验统计,香烟烟雾中有1000多种化合物。其中至少有300种化合物在不同程度上有毒,如一氧化碳、尼古丁、醛类等。某化学课外活动小组设计实验检验香烟烟雾中存在一氧化碳、尼古丁、醛类等有毒物质。
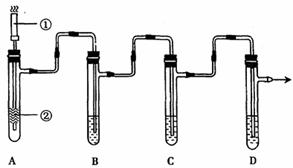
如上图,D试管的支管与抽气装置相连,从D试管的支管处抽气,可使A上燃着的香烟的烟雾依次通过A、B、C、D四个装置,且每个装置只能吸收一种物质(A处香烟可连续燃烧)。
(1)尼古丁的结构如图,在尼古丁结构式中六元环上的一氯取代物
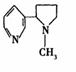 有_______种。
有_______种。
(2)若用B装置检验醛类物质,则试管B中盛装的试剂是________
____________。
(3)已知:在血液中存在下述平衡:
 血红蛋白-O2+CO 血红蛋白-CO+O2
血红蛋白-O2+CO 血红蛋白-CO+O2
(血红色) (鲜红色)
若用D装置检验CO的存在,则可采用D试管中加入5mL新鲜动物血,其实验现象为______________________________________________________________________。该气体对人体有害,当发生中毒时,可采取的两种措施是①______________________;②______________________________。依据的原理是____________________________
__________________________________________________________________________。


 高☆考♂资♀源?网 ☆
高☆考♂资♀源?网 ☆
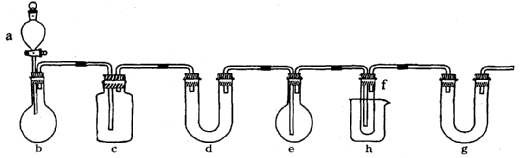
4.(15分)PCL3有毒,在潮湿的空气中可发生水解反应产生大量的白雾。它在实验室和工业上都有重要的应用。在实验室中可用下图所示装置(酒精灯、铁架台等未画出)制取PCL3,在圆底烧瓶e中放入足量白磷,将CL2迅速而有不间断地通入e中,氯气与白磷会发生反应,产生火焰。

 高☆考♂资♀源?网 ☆
高☆考♂资♀源?网 ☆
三氯化磷和五氯化磷的物理常数如下:
|
|
熔点 |
沸点 |
|
三氯化磷 |
-112℃ |
76℃ |
|
五氯化磷 |
148℃ |
200℃分解 |
图中a、b应该装入的试剂或药品分别是浓盐酸和二氧化锰,并在b仪器处加热。请据此回答下列问题:

 高☆考♂资♀源?网 ☆
高☆考♂资♀源?网 ☆
(1)写出b中发生反应的化学方程式:____________________________________。
(2)氯气和白磷反应放出大量的热,为使仪器e不致因局部过热而炸裂,实验开始前应在e的底部放少量_______________________。
(3)在烧杯h中加入冰盐水,其作用是_________________________________。
(4)C中所盛装的试剂是_______,其作用是_______________________________。
(5)实验室将白磷保存于水中,取出的白磷用滤纸初步吸去表面水分,然后浸入无水酒精中片刻,再浸入乙醚中片刻即可完全除去水分。已知酒精与乙醚互溶,乙醚易挥发。用上述方法除去水分的原因是___________________________
______________________________。
3.(18分分)

 高☆考♂资♀源?网 ☆
高☆考♂资♀源?网 ☆
(1)下列仪器在使用前必须检查其是否漏水的是 (多选倒扣分,下题同)
A.胶头滴管 B.温度计 C.容量瓶 D.分液漏斗
E.长颈漏斗 F.酸式滴定管 G.烧杯 H.干燥管
(2)利用上述仪器和一些非玻璃仪器,及必要试剂可进行的实验有 。
①中和热的测定 ②用0.1045mol/L NaOH溶液滴定25ml未知浓度HCl
③分离苯和苯酚 ④实验室制备乙烯
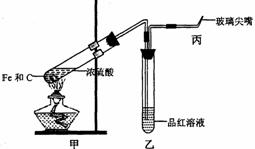 (3)某同学为研究硫酸的性质,设计了以下实验。检查好装置的气密性后,在甲的试管中加入足量的Fe和C,然后,加入少量浓硫酸。
(3)某同学为研究硫酸的性质,设计了以下实验。检查好装置的气密性后,在甲的试管中加入足量的Fe和C,然后,加入少量浓硫酸。
①在未点燃酒精灯时,乙中没有明显现象,这是因为 ;为处理生成的有毒
气体,还应在乙、丙之间接入(1)中 (填仪器名称),并在其中填充足量的
碱石灰。
②接入该仪器后,点燃酒精灯,反应开始一段时间后,在丙处检验到某种无色无味气体,
它是 。由于甲中加入了单质碳,使丙处产生气体的速率比不加入时快,这是
因为 。
③设计简单实验,通过观察丙处现象,判断甲中反应基本结束,请简述操作及有关现象
。
1.(16分)用右图装置,进行硝酸与铜片反
应的实验,同时,为了防止污染,在试管
B里盛B里盛放足量氢氧化钠溶液,以吸
收反应产生的气体。
(1)实验前如何检查该装置的气密性
。
(2)若实验使用的试剂是质量分数为63%的硝酸和小铜片,操作中怎样加入硝酸和铜
片才能避免铜片与硝酸刚一接触时生成的气体外逸到空气中 。
。
该反应中可能会出现哪些实验现象
。
(3)若使用的试剂是1mol·L-1的硝酸和小铜片,则A试管中所发生反应的化学方程
式是 ,实验
结束后试管B中的溶液所含的溶质有(写化学式)
。
(4)为了从上述实验中获得纯净的NO,拟用以下装置除去NO中的杂质,将试管A
与下图C、D装置相连,最好选用表中的 方法(填编号),理由是 。
|
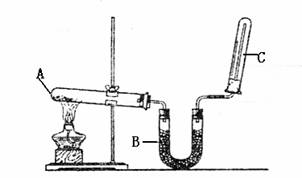 2.(18分)实验室用右图所示装置制取干燥的氨气
2.(18分)实验室用右图所示装置制取干燥的氨气

 高☆考♂资♀源?网 ☆
高☆考♂资♀源?网 ☆
(1)写出A处所发生反应的化学方程式 ,
(2)B装置的作用是 B装置内所盛药品的名称为 。
(3)若以a1、a2分别表示浓度为Xmol/L和Ymol/L的氨水的质量分数,且知X=2Y
则这两种氨水质量分数的关系为 (氨水的密度比水小)
A.a1=2a2 B.2a2>a1 C.a1>2a2 D.无法确定
(4)如何检验氨气是否收集满 ,
(5)有位同学只用了一个圆底烧瓶、带玻璃管的橡皮塞、胶管、止水夹、酒精灯、少量浓氨水,大烧杯及水即做成了喷泉实验,制备氨气时,他是怎么操作的 ,
简述原理 。
8.在密闭容器中,反应达平衡时,A的浓度为0.5mol/L若保持温度不变,将容器的容积扩大到原来的2倍,达新平衡时A的浓度降为0.3mol/L。下列判断正确的是( )
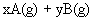

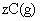
(A)X+Y<Z (B)平衡向正反应方向移动 (C)B的转化率降低 (D)C的体积分数下降
7.在一定条件下,在四个相同容积的密闭容器中分别充入表中四种配比的气体,发生的反应是
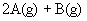

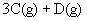
达平衡后,两个容器内四种物质的浓度均相同的是( )
(A)①和③ (B)①和② (C)②和④ (D)③和④
6.在一定温度下,向一个容积固定的密闭容器中充入2mol X气体,发生反应
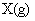

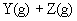 使反应达到平衡,这时容器中混合气体中X气体体积分数是a%。若在同一容器中,最初放入的是1mol Y和1mol Z的混合气体,并在相同的温度下使反应达到平衡,这时混合气体中X气体所占的体积分数是b%。则a和b的关系是(
)
使反应达到平衡,这时容器中混合气体中X气体体积分数是a%。若在同一容器中,最初放入的是1mol Y和1mol Z的混合气体,并在相同的温度下使反应达到平衡,这时混合气体中X气体所占的体积分数是b%。则a和b的关系是(
)
(A)a>b (B)a=b (C)a<b (D)2a=b
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com