
题目列表(包括答案和解析)
3. 答案
(1)吸热(1分),逆向(1分);
(2)C2H5OH(g) → C2H4(g) + H2O(g) – 46KJ(1分)
(3)K=(1分), a、b;(2分)
(4)大于(1分),150~175℃(1分)。
3. 乙醇脱水反应在不同温度条件下得到的产物组成不同。下表是常压、某催化剂存在条件下,分别以等量乙醇在不同温度下进行脱水实验获得的数据,每次实验反应时间均相同。


已知:乙醇和乙醚(CH3CH2OCH2CH3)的沸点分别为78.4℃和34.5℃。试分析:
 (1)乙醇脱水制乙烯的反应是________(填“放热”、“吸热”)反应,若增大压强,平衡_____________(选填“正向”、“逆向”、“不”)移动;
(1)乙醇脱水制乙烯的反应是________(填“放热”、“吸热”)反应,若增大压强,平衡_____________(选填“正向”、“逆向”、“不”)移动;
(2)已知:150℃时,1mol乙醇蒸汽脱水转变为1mol乙烯,反应热的数值为46KJ,写出该反应的热化学方程式____________________________________;
(3)写出乙醇脱水制乙醚的反应的平衡常数表达式________________。当乙醇起始浓度相同时,平衡常数K值越大,表明 (填序号);
a.乙醇的转化率越高 b.反应进行得越完全
c.达到平衡时乙醇的浓度越大 d.化学反应速率越快
(4)根据表中数据分析,150℃时乙醇催化脱水制取的乙醚产量______(选填“大于”、“小于”、“等于”)125℃时;为了又快又多地得到产品,乙醇制乙醚合适的反应温度区域是______。
2.(1)否 (1分) AB (2分) (2)C (1分) (3)D(1分)
(4)= (2分) (5)10-13或1.0×10-13 (1分)
(6)12 (2分)
2. I .图为向25mL 0.1 mol·L-1 NaOH溶液中逐滴滴加0.2 mol·L-1 CH3COOH溶液过程中溶液pH的变化曲线。请回答:

(1)B点溶液呈中性,有人据此认为,在B点时NaOH与CH3COOH恰好完全反应,这种看法是否正确? (1分)(选填“是”或“否”)。若不正确,则二者恰好完全反应的点是在AB区间还是BD区间内? 区间(若正确,此问不答)(2分)
(2)关于该滴定实验,从下列选项中选出最恰当的一项 。(选填字母)(1分)
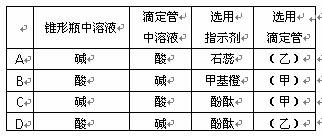
(3)AB区间,c(OH-)>c(H+),则c(OH-)与c(CH3COO-)大小关系
是 (1分)
A.c(OH-)一定大于c(CH3COO-)
B.c(OH-)一定小于c(CH3COO-)
C.c(OH-)一定等于c(CH3COO-)
D.c(OH-)大于、小于或等于c(CH3COO-)
(4)在D点时,溶液中c(CH3COO-)+c(CH3COOH) 2c(Na+)。
(填“>”、“<”或“=”)(2分)
II.t℃时,某稀硫酸溶液中c(H+)=10-a mol·L-1,c(OH-)=10-b mol·L-1,已知
a+b=13 :
(5)该温度下水的离子积常数K w的数值为 。(1分)
 (6)该温度下(t℃),将100mL 0.1 mol·L-1的稀H2SO4溶液与100mL 0.4 mol·L-1的
(6)该温度下(t℃),将100mL 0.1 mol·L-1的稀H2SO4溶液与100mL 0.4 mol·L-1的
NaOH溶液混合后(溶液体积变化忽略不计),溶液的pH= 。(2分)
1. I.(1)90%(1分)5670L·mol-1(2分,漏掉或写错单位扣1分)
Ⅱ.(1)2C2H6(g)+7 O2(g)=4CO2(g)+6H2O (l) △H=-3116.6KJ·mol-1(2分)
C2H6+18 OH― → 2CO32― +12H2O+14e- [或C2H6+14 OH― → 2CO2+10H2O+14e-](2分)
(3)4 OH― →2 H2O +O2↑+4e-(1分)氧化铜 4g [或碳酸铜 6.2g或氧化亚铜7.2g](2分)
1. I.如下图所示,将2molA气体和1molB气体充入一容积可变的密闭容器中。
 发生反应:2A(g)+B(g)
发生反应:2A(g)+B(g) 2C(g)。反应开始时可滑动的活塞的位置如图1所示,当反应达到平衡时,活塞位置如图2所示.则达到平衡时,A的转化率为________________;
2C(g)。反应开始时可滑动的活塞的位置如图1所示,当反应达到平衡时,活塞位置如图2所示.则达到平衡时,A的转化率为________________;
该条件下反应的平衡常数为_______________________________。

Ⅱ.(1)已知298K时,1molC2H6在氧气中完全燃烧生成二氧化碳和液态水,放出热量1558.3KJ。写出该反应的化学方程式__________________________________________.
(20利用该反应设计一个燃料电池:用氢氧化钾溶液做电解 质溶液,用多孔石墨做电极,在电极上分别充入乙烷和氧气。写出负极的电极反应式____________________________
 (3)有如图是化学实验装置图,
(3)有如图是化学实验装置图,
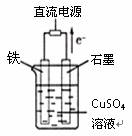
石墨棒上的电极反应式为_______________________________;
如果起始时盛有1000mLpH=5的硫酸铜溶液(25℃)(CuSO4 足量),一段时间后溶液的pH变为1,若要使溶液恢复到起始浓度(忽略溶液体积的变化),可向溶液中加入________(填物质名称),其质量为_______________.
8. 要同时测定混有少量KCl杂质的明矾KAl(SO4)2·nH2O的纯度和结晶水的含量,按下列流程进行实验:

(1) 
(1)晶块磨碎时使用的仪器名称 ,加热脱水时使用的容器名称 ,若加热过程中有固体飞溅出来造成损失,则会使测得结晶水的含量偏 。
(2)在加热结束后和称量质量之前的这段时间里,需要进行的实验操作是
。
(3)实验步骤中加入的A溶液应是 溶液。
(4)若加入A溶液的量不足,则会使测得的纯度偏 ,判断A溶液是否足量的方法是
。
(5)过滤时,玻璃棒的作用是 ,把滤纸上的沉淀洗涤干净,洗涤沉淀物的方法是 。
 (6)通过实验,测得明矾化学式中n值为12,则明矾的纯度为
%。
(6)通过实验,测得明矾化学式中n值为12,则明矾的纯度为
%。
7.(1)将混合物注入分液漏斗,加入酸性高锰酸钾溶液,振荡,再往混合应液中加入一定量的氢氧化钠溶液振荡、静置、分液(3分) (2)检验并除去气态不饱和烃 (2分)(3)无法判定E中是否有水产生 (2分)(4)气态烷烃(1分) 选用仪器、药品合理均给分(2分)
7. 废旧塑料回收和利用是减轻“白色污染”、实现资源再利用的有效途径之一。某兴趣小组进行如下探究:
[实验课题]废旧聚丙烯塑料热分解主要产物的探究
[查阅资料]①石蜡热分解的产物为常温下的气态烃和液态烃
②CuO能将烃氧化成CO2和H2O
③苯甲酸能溶于苯
[实验设计]
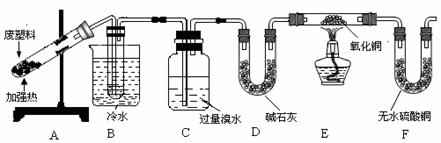
[实验记录]
①B装置试管中有液态物质生成;②C中溴水的颜色变浅;③E装置中黑色氧化铜变红;④F装置中无水硫酸铜变蓝。
[问题讨论]请你参与实验设计的评价和实验结果的分析:
(1)经分析得知B装置试管中的液态产物是甲苯和苯的混合物。若要除去其中的甲苯,实验操作方法是 ;
(2)C装置的作用是 ;(3)如果不设置D装置,对实验结论产生的影响是 ;
(4)甲同学认为从C中出来的气体是氢气,乙同学认为还可能有其它成分。你认为其他成分可能是 。为完善实验设计,请在上图方框内画出装置图并注明其中盛放的试剂名称。
6.(1)铝(或Al)(1分)(2)锌(或Zn)(1分)(以上两空可颠倒)
(3)NaOH溶液(或氢氧化钠溶液),无“溶液”两字不扣分;(2分)
 (4)在滤液中加入稀硫酸(1分)直至生成的沉淀刚好溶解(1分),再加入足量(1分)的稀氨水(1分); (5)步骤简单(1分),节约试剂(1分);
(4)在滤液中加入稀硫酸(1分)直至生成的沉淀刚好溶解(1分),再加入足量(1分)的稀氨水(1分); (5)步骤简单(1分),节约试剂(1分);
(6)将沉淀C洗涤、小心干燥后称量(2分)。

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com