
题目列表(包括答案和解析)
3.答案:A
[考点]本题考查了化学反应实验现象的描述。
[解析]氢气在氯气中燃烧生成苍白色火焰,有白雾生成,A错。
2.答案:C
[解析]此题考查化学实验基本操作规范性。A要吸干表面的煤油再切,B中容量瓶不能配制溶液,D中分液时下层液体从下口放出,上层液体从上口倒出。
14.(2009理综全国卷I,11)(6分)为了检验某含有NaHCO3杂质的Na2CO3样品的纯度,现将w1 g样品加热,其质量变为w2 g,则该样品的纯度(质量分数)是( )
A.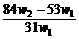 B.
B. C.
C. D.
D.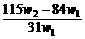
高考真题答案与解析
化 学
[考点14]钠及其化合物
|
Fe(OH)3、CaCO3。
(2)“趁热过滤”的原因是使析出的晶体为Na2CO3·H2O,防止因温度过低而析出Na2CO3·10H2O晶体,令后续的加热脱水耗时长。
(3) 若在实验室进行“趁热过滤”,可采取的措施是用已预热的布氏漏斗趁热抽滤。
(4) 若“母液”循环使用,可能出现的问题及其原因是问题:溶解时有大量沉淀生成,使Na2CO3损耗且产物Na2CO3混有杂质;原因:“母液”中,含有的离子有Ca2+,Na+,Cl -,SO42-,OH -,CO32-,当多次循环后,使用离子浓度不断增大,溶解时会生成CaSO4,Ca(OH)2,CaCO3等沉淀。
(5) 写出Na2CO3·H2O脱水反应的热化学方程
Na2CO3·H2O(S)==== Na2CO3(s) + H2O(g) H= +58.73kJ/mol
[解析]
(1)因工业碳酸钠中含有Mg2+,Fe3+,Ca2+,所以“除杂”中加入过量的NaOH溶液,可生成Mg(OH)2、Fe(OH)3、Ca(OH)2沉淀。
(2)观察坐标图,温度减少至313K时发生突变,溶解度迅速减少,弱不趁热过滤将析出晶体。
(3)思路方向:1.减少过滤的时间 2.保持过滤时的温度。
(4)思路:分析“母液”中存在的离子,若参与循环,将使离子浓度增大,对工业生产中哪个环节有所影响。
(5)通过观察两个热化学方程式,可将两式相减,从而得到Na2CO3·H2O(S)==== Na2CO3(s)+ H2O(g)。
13.(2009理综全国卷II8)(6分)下列叙述中正确的是 ( )
A.向含有CaCO3沉淀的水中通入CO2至沉淀恰好溶解,再向溶液中加入NaHCO3饱和溶液,又有CaCO3沉淀生成。
B.向Na2CO3溶液中逐滴加入等物质的量的稀盐酸,生成的CO2与原Na2CO3的物质的量之比为1:2.
C.等质量的NaHCO3和Na2CO3分别与足量盐酸反应,在同温同压下,生成的CO2体积相同
D.向Na2CO3饱和溶液中通入CO2,有结晶析出
12.(2009上海化学10)(3分) 9.2 g金属钠投入到足量的重水中,则产生的气体中含有 ( )
A.0.2 mol中子 B.0.4 mol电子
C.0.2 mol质子 D.0.4 mol分子
11.(2009海南化学3)(3分)除去NaHCO3溶液中混有的少量Na2CO3可采取的方法是 ( )
A.通入二氧化碳气体 B.加入氢氧化钡溶液
C.加入澄清石灰水 D.加入稀盐酸
10.(2009宁夏理综27)(15分)下图表示有关物质(均由短周期元素形成)之间的转化关系,其中A为常见的金属单质,B为非金属单质(一般是黑色粉末),C是常见的无色无味液体,D是淡黄色的固体化合物。(反应条件图中已省略。)

(1)A、B、C、D代表的物质分别为 、 、 、 (填化学式);
(2)反应①中的C、D均过量,该反应的化学方程式是 ;
(3)反应②中,若B与F物质的量之比为4∶3,G、H分别是 、 (填化学式);
(4)反应③产物中K的化学式为 ;
(5)反应④的离子方程式为 。
9.(10分)(2008海南化学16)现拟在实验室里利用空气和镁粉为原料制取少量氮化镁(Mg3N2)。已知实验中可能会发生下列反应 ( )
①2Mg+O2 2MgO;②3Mg+N2
2MgO;②3Mg+N2  Mg3N2;③2Mg+CO2
Mg3N2;③2Mg+CO2 2MgO+C;
2MgO+C;
④Mg+H2O MgO+H2↑;⑤Mg3N2
+6H2O =3Mg(OH)2↓+2NH3↑
MgO+H2↑;⑤Mg3N2
+6H2O =3Mg(OH)2↓+2NH3↑
可供选择的装置和药品如下图所示(镁粉、还原铁粉均已干燥,装置内所发生的反应是完全的,整套装置的末端与干燥管相连)。

回答下列问题;
(1)在设计实验方案时,除装置A、E外,还应选择的装置(填字母代号)及其目的分别 。
(2)连接并检查实验装置的气密性。实验开始时,打开自来水的开关,将空气从5升的储气瓶压入反应装置,则气流流经导管的顺序是(填字母代号) 。
(3)通气后,如果同时点燃A、F装置的酒精灯,对实验结果有何影响? ,原因是 。
(4)请设计一个实验,验证产物是氮化镁: 。
8.(2009海南化学3)除去NaHCO3溶液中混有的少量Na2CO3可采取的方法是 ( )
A.通入二氧化碳气体 B.加入氢氧化钡溶液
C.加入澄清石灰水 D.加入稀盐酸
7.(2009广东文基65)下列有关金属及其化合物的说法正确的是 ( )
A.1 L生理盐水(0.9%NaCl溶液)中含有9 molNa+
B.出土的古代铜制品表面覆盖着铜绿,其主要成分是CuO
C.装修门窗使用的铝合金材料的硬度比铝小,熔点比铝低
D.节日燃放的烟花是某些金属元素发生焰色反应所呈现出来的色彩
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com