
题目列表(包括答案和解析)
24.答案: BC
[解析]由图可知,随温度升高,c(I3- )浓度减小,平衡逆向移动,说明正反应放热,即DH<0,A项错。同理可推出,升温,K值减小,即K1>K2,B项正确。D点没有平衡,c(I3- )偏小(要向A点移动),即反应要向右进行,所以此时v (正)>v (逆),C项正确。由图知,c(I3- ):状态A>状态B,则c(I2)为:状态A<状态B,所以D项错。
23.答案: C。
[解析]该反应为气体计量数减小的放热反应。升温,平衡逆向移动,生成物浓度减小,反应物浓度增大,平衡常数减小,同时,CO的转化率减小,故A项、B项都错;平衡常数只与温度有关,与物质的量无关,C项正确;增加氮气的物质的量,平衡逆向移动,NO的转化率减小,D项错。
22.答案: C
[解析]题中有一明显的错误,就是C选项中平衡常数增大,增大压强不可能使平衡常数增大。其他选项均为平衡中的基础计算和基础知识,关键是根据表中数据(0.1-0.05):(0.2-0.05):(0.1-0) = 1:3:2可推导出:X+3Y 2Z。
2Z。
0.3 mol ← 11.2 g
v (CO)
=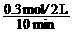 = 0.015 mol/(L·min)
= 0.015 mol/(L·min)
(2)可逆反应达平衡时的特征有二:一是v (正) = v (逆);二是各物质的“量”不再随时间的变化而增减,其中“量”包含质量、物质的量、物质的量浓度、质量分数等;固体的量多少虽不影响化学平衡,但平衡时,固体的量也不会增减,所以在不加入物质的情况下,固体的量是否增减也可作为判断平衡状态的依据;此反应也可用气体密度是否变化来判断平衡状态,但不是本题所设问的;对前后体积变化的可逆反应还可用压强是否变化来判断是否平衡;若反应中含有有色气体,还可通过气体的颜色变化来判断。
(3)温度升高,反应速率增大,排除c项;由于此反应条件下不是可逆反应,排除d项;由于反应是在引燃(高于273 K)时才反应,所以曲线不会从0点开始,排除a项。
(4)Al(OH)3是两性氢氧化物,其电离方程式为:(碱式电离)Al3++3OH- Al(OH)3
Al(OH)3 H++AlO2- +H2O(酸式电离),从上可知,欲使Al3+浓度增大(平衡左移),可加入强酸(盐酸、硫酸等)。
H++AlO2- +H2O(酸式电离),从上可知,欲使Al3+浓度增大(平衡左移),可加入强酸(盐酸、硫酸等)。
21答案:(1)
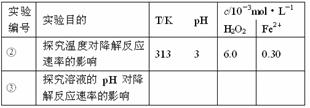
(2)8×10-6 mol·L-1·s-1。 (3)H2O2在温度过高时迅速分解。
(4)反应不能进行。
(5)在溶液中加入碱溶液,使溶液的pH大于或等于10。
[解析](2)根据实验①中曲线,在50 s ~150 s内,v (p-CP) = (1.2×10-3 mol·L-1-0.4×10-3 mol·L-1)/100 s = 8×10-6 mol·L-1·s-1。
(3)题中条件(从所用试剂H2O2的角度分析)为解题指明了方向。
(4)题中只要求回答结论,而不要求原因分析,降低了难度。可能原因是当溶液pH增大时,Fe2+被沉淀了,不利于该反应的进行。
(5)从(3)、(4)知,使该反应减慢可用二种方法:一是温度过高,二是pH≥10。方法一不易操作,且不能迅速停止,方法二易于操作,且能迅速停止。
20.答案: (1) ; 0.015 mol/(L·min)。
; 0.015 mol/(L·min)。
(2)①CO(或CO2)的生成速率与消耗速率相等;②CO(或CO2)的质量不再改变;③CO(或CO2)的物质的量浓度不再改变; 等等(合理即给分)
(3) b。
(4)Al(OH)3 H++AlO2- +H2O 盐酸(合理即给分)。
H++AlO2- +H2O 盐酸(合理即给分)。
[解析](1) 3CO(g) - 2Fe(s)
3 mol 2×56 g
19.答案: A
[解析]不管是吸热反应还是放热反应,温度升高正逆反应速率均加快,温度降低正逆反应速率均减慢,A项错。催化剂可同等程度的提高正逆反应速率,但B项中没提及逆反应速率,所以B项正确。
18.答案: D
[解析]B项中,如果是在恒容时通入惰性气体,虽增大了体系的总压强,但反应混合物的浓度未变,反应速率不变,所以B项错。
17.答案: D
[解析]从表中数据看,①④中CH3COCH3、HCl的浓度是相同的,而④中Br2比①中的大,所得结果,时间变长,即速率变慢了,D项错。其他选项依次找出表中两组相同的数据,看一变量对另一变量的影响即可。
[考点分析]此题考查了在有机化学反应中影响化学反应速率的相关知识。(知识点考察单一,难度提升)
16.答案: D
[解析]本题中影响反应速率的因素有浓度和温度。A与C浓度相同,从温度可知反应速率是A<C;B与D浓度相同,从温度可知反应速率是B<D;下面比较C与D项:二者温度相同,比较浓度:
c(Na2S2O3):5×0.1/20(C项)<5×0.2/20(D项);
c(H2SO4): 10×0.1/20(C项) = 5×0.2/20(D项)。
故D项的反应速率大于C项,选D。
15.答案:(1)25% (2)增大 (3)6 (4)41%
[解析]本题主要考查了化学平衡移动、转化率、平衡常数等基本概念和基本计算,具有较强的综合性。在解题中注意平衡常数与转化率的巧妙应用,这也是本题的关键所在。
(1)N的转化率为

|
(2)因为反应△H>0,是吸热反应,所以升高温度,平衡向正反应方向移动,M的转化率增大。
(3)根据反应
 M(g) + N(g) P(g) +
Q(g)
M(g) + N(g) P(g) +
Q(g)
起始浓度:4mol·L-1 a mol·L-1 0 0
转化浓度:2mol·L-12mol·L-12mol·L-1 2mol·L-1
平衡浓度:2mol·L-1(a–2)mol·L-12mol·L-12mol·L-1
根据温度不变,平衡常数不变的特点
K=2mol·L-1×2mol·L-1/[2mol·L-1×(a –2) mol·L-1]=0.6mol·L-1×0.6mol·L-1/[0.4mol·L-1×1.8mol·L-1]得a =6mol·L-1
 (4)同理:M(g) +
N(g)
P(g) + Q(g)
(4)同理:M(g) +
N(g)
P(g) + Q(g)
起始浓度:bmol·L-1 b mol·L-1 0 0
转化浓度:xmol·L-1xmol·L-1xmol·L-1 xmol·L-1
平衡浓度:(b-x)mol·L-1(b–x)mol·L-1xmol·L-1xmol·L-1
根据温度不变,平衡常数不变的特点
K=x2/(b – x )2=0.6mol·L-1×0.6mol·L-1/[0.4mol·L-1×1.8mol·L-1]得x=0.41b mol·L-1
a(M)=(0.41b/b)×100%=41%
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com