
题目列表(包括答案和解析)
13.答案:(8分)
(1)4CmHn+(4m+n)O2=4mCO2+2nH2O(2分) 化学 热(2分)
(2)SO2(2分)
(3)2NOx+2xCO N2+2xNO2(2分)
N2+2xNO2(2分)
[解析](1)汽油燃烧的化学方程式为:
4CmHn +(4m+n)O2=2nH2O + 4mCO2 ,燃烧过程为化学能转化为热能。
(2)精炼汽油可以减少其中硫的含量从而减少二氧化硫的排放大。
(3)这和(1)一样,也是属于对未知物反应方程式的配平:2NOx+ 2xCO  N2
+ 2x CO2
N2
+ 2x CO2
12.答案:
(1)Cu、O
(2)b、c
(3)2Fe3++2I-=2Fe2++I2
S2O82-+2Fe2+=2SO42-+2Fe3+(离子方程式不配平不扣分)
(4)a:稀硫酸、KMnO4溶液
b:稀硫酸浸取炉渣所得溶液能使KMnO4溶液褪色
[解析](1)若CuFeS2中Fe的化合价为+2,则Cu化合价为+2,S化合价为-2,分析化学方程式两边元素化合价的变化可知,化合价降低的元素被还原,有Cu和O元素。关于SO2的吸收问题,一是不能高空排放,因为这样做,没有从根本上解决污染问题;二是不能用浓硫酸吸收,因SO2难溶于浓硫酸。只有变废为宝,才能符合“绿色化学”的概念,答案选b、c.
(2)此题要从催化剂的本质出发,作为催化剂的物质要参与有关反应,但后来的反应必须又生成了催化剂。本题要求写出表示Fe3+作催化剂的反应,因此,首先Fe3+要参与反应,即有反应2Fe3++2I-=2Fe2+ +I2,生成的Fe2+又被S2032-氧化生成了Fe3+。此题若要求写出Fe2+对上述反应的作催化剂的话,就应写成如下方程式:S2082-+Fe2+=2SO42-+2Fe3+,2Fe3++2I-=2Fe2+ +I2,虽是二个相同反应方程式,由于二者的前后顺序的颠倒,却产生了本质的区别。
(3)此题考查是混合物的分离与提纯及常见离子的鉴别。因Al2O3溶于酸后生成了Al3+,Al3+又能与过量NaOH的反应生成可溶性的钠盐(NaAlO2),然后将溶液中的难溶物Fe(OH)3沉淀过滤出来,将沉淀洗涤、干燥、煅烧得Fe2O3。故除去Al3+的离子方程式是Al3++4OH-=AlO2-+2H2O。要证明炉渣中含有FeO的方法,最好利用Fe2+的还原性,先将混合物溶于过量的稀硫酸中(FeO→Fe2+),然后滴入KMn04溶液,观察其溶液是否褪色。注意所用酸不能是硝酸或盐酸,因硝酸会将Fe2+氧化成Fe3+;盐酸会还原KMn04溶液而使之褪色,干扰了Fe2+的检验。
11.答案:(11分)(1)Cu2S (2)Cu2O,Cu2S
(3)形成酸雨,会对植物和建筑物造成严重损害 硫酸 硫酸铵 电解池中,粗铜作阳极,精铜作阴极,电解质为硫酸铜溶液。阳极上发生氧化反应,Cu失去电子,使Cu单质变为Cu2+进入溶液中Cu-2e- === Cu2+;阴极上发生还原反应,Cu2+得到电子在阴极上析出Cu单质,Cu2++2e- === Cu,从而达到精制Cu的目的 (5)A D
[解析]
(1)上表所列铜化合物中,铜的质量百分含量最高的是Cu2S
解释:CuFeS2:34.8% ;Cu5FeS4:63.5% ;Cu2S:80% ;CuCO3·Cu(OH)2:57.6%
(2) 反应的氧化剂是Cu2O,Cu2S
解释:Cu2O,Cu2S的Cu由+1被还原为0价,作氧化剂;Cu2S的S有-2价被氧化为+4价,作还原剂。
(3) SO2尾气直接排放到大气中造成环境污染的后果是形成酸雨。处理该尾气可得到有价值的化学品,写出其中1种酸和1种盐的名称硫酸,硫酸铵。
解释:处理SO2尾气一般为循环制备硫酸,和用Ca(OH)2 或氨水吸收,可得到CaSO4和(NH4)2SO4等有价值的化学品。
(4) 简述粗铜电解得到精铜的原理:电解池中,粗铜作阳极,精铜作阴极,电解质为硫酸铜溶液。阳极上发生氧化反应,Cu失去电子,使Cu单质变为Cu2+进入溶液中Cu- 2e- == Cu2+;阴极上发生还原反应,Cu2+得到电子在阴极上析出Cu单质,Cu2++ e- == Cu,从而达到精制Cu的目的。
(5) A.D
解释:稀盐酸可以同Cu(OH)2与CuCO3反应,而且稀盐酸不能于Cu反应。所以稀盐酸可以除铜器表面的铜绿(CuCO3·Cu(OH)2),A正确。
铜表面不能形成致密氧化膜;铜和浓硫酸在常温下是反应的,生成硫酸铜、SO2和水,反应很慢,反应过程中放热,随着反应的进行,速率会越来越快的,所以不能用铜制容器装浓硫酸,B错误。
因为Fe比Cu活泼,所以Fe-Cu形成的原电池中,Fe作负极,更容易被氧化生绣,C错误。
蓝色硫酸铜晶体受热转化为白色硫酸铜粉末,只有旧键的断裂,没有新键的形成(CuSO4·5H2O中,H2O与Cu2+有配位键),故不属于化学变化,只有物理变化;CuSO4可用作消毒剂,但与前者没有因果关系,D正确。
综上所述,答案选AD。
10.答案:(1)3 6 2 1 6 (2)N2 Si3N4
(3) (或
(或 )
)
(4)小于 减小 (5)逆 (6)6
 [解析](1)利用观察法配平或利用氧化还原反应中的电子守恒来配平。配平后的化学方程式为3SiO2 +6C+2N2
[解析](1)利用观察法配平或利用氧化还原反应中的电子守恒来配平。配平后的化学方程式为3SiO2 +6C+2N2 Si3N4
+ 6CO。
Si3N4
+ 6CO。
(2)分析各物质的化合价变化情况:C元素由0价升高为+2价,在反应中作还原剂被氧化;N元素的化合价由0价降低为-3价,在反应中作氧化剂被还原。因此,此反应的氧化剂为N2,还原产物为Si3N4。
(3)因SiO2、C、Si3N4均为固体,只有N2和CO为气体,存在平衡浓度(或平衡分压),因此根据化学平衡常数的表达式可以得出此反应的平衡常数表达式为 或
或 。
。
(4)放热反应的焓变△H<0,升高温度,此平衡向左移动,使[CO]减小、[N2]增大,因此平衡常数K值减小。
(5)由于此反应的正反应为气体体积增大的反应,因此增大压强,此平衡将向逆反应方向移动。
(6)根据同一反应在同一时间段内,各物质的反应速率之比等于各物质在化学方程式中对应的计量数之比。则有 ,所以v(N2)=
,所以v(N2)=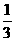 v(CO)=
v(CO)=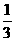 ×18mol·L-1·min-1=6mol·L-1·min-1。
×18mol·L-1·min-1=6mol·L-1·min-1。
9.答案:C
[解析]设此铅氧化物的化学式PbxOy ,
PbxOy- y[O]- yCO- y CO2- yCaCO3
16y 100y
m(O)=1.28g 8.0g
所以m(Pb) = 13.7g- 1.28g = 12.42g
x∶y =  ∶
∶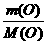 =3∶4
=3∶4
8.答案:C
[解析]根据氯气的性质可以知道氯气是一种有毒的气体,因氯气与水反应生成的HClO具有强氧化性,所以常用氯气对自来水消毒杀菌。因此C选项是错误的。
[考点分析]化学与生活综合运用
7.答案:A
[解析]反应①2Fe+O2+2H2O=2Fe(OH)2中的氧化剂是O2,1molO2在反应中得到4mol电子,同样在反应②4Fe(OH)2+O2+2H2O=4Fe(OH)3中氧化剂也是O2,而且两个反应中氧气的系数都是1,因此得到的电子均是4mol,故A选项正确B选项错误。钢质水管与铜质水龙头连接后形成原电池,其中钢质水管做负极被腐蚀,故C选项错误。钢铁在潮湿的空气中容易发生电化学腐蚀,而且主要是发生吸氧腐蚀,因此D选项错误。
6.答案:CD
[解析]由氧化还原反应的强弱律可知,氧化性是氧化剂大于氧化产物,还原性是还原剂大于还原产物,由方程一可知,氧化剂H2O2氧化性比氧化产物Fe3+强,由方程二可知,还原剂H2O2还原性比,原产物为Fe2+强,所以A错误;方程一和方程二相加,即H2O2分解生成H2O和O2,H2O2呈弱酸性,所以随着反应进行,pH升高,B错误;H2O2分解Fe3+或Fe2+作催化剂,所以总量不变,C正确;因为Fe2+可导致H2O2分解,所以H2O2生产过程要避免混入Fe2+,D正确。
5.答案:C
[解析]置换反应中肯定有单质参加,一定属于氧化还原反应,即一定有电子转移,C项正确。
4.答案:D
[解析]此题主要考查氧化还原反应的配平:
Zn+HNO3(稀) Zn(NO3)2+NH4NO3+H2O,Zn:0→+2,化合价改变值为:(2-0)×1=2,N:+5→-3,化合价的改变值为:(5+3)×1=8,根据化合价升降总值相等得:在Zn(NO3)2前配4,NH4NO3前配1,然后根据反应前后各元素的原子个数相等,找出其他物质的系数。配平后的化学方程式为:4Zn+10HNO3(稀)===4Zn(NO3)2+NH4NO3+3H2O,当生成1mol的Zn(NO3)2时,被还原的HNO3为0.25mol。
Zn(NO3)2+NH4NO3+H2O,Zn:0→+2,化合价改变值为:(2-0)×1=2,N:+5→-3,化合价的改变值为:(5+3)×1=8,根据化合价升降总值相等得:在Zn(NO3)2前配4,NH4NO3前配1,然后根据反应前后各元素的原子个数相等,找出其他物质的系数。配平后的化学方程式为:4Zn+10HNO3(稀)===4Zn(NO3)2+NH4NO3+3H2O,当生成1mol的Zn(NO3)2时,被还原的HNO3为0.25mol。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com