
题目列表(包括答案和解析)
8、对于C60与棒碳,下列说法正确的是
A.C60在一定条件下可能与CuO发生置换反应 B.棒碳不能使溴水褪色
C.C60与棒碳中所有的化学键都是非极性共价键 D.棒碳与乙炔互为同系物
7、右表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是
A.常压下五种元素的单质中,Z单质的沸点最高
B.Y、Z的阴离子电子层结构都与R原子的相同
C.W的氢化物的沸点比X的氢化物的沸点高
D.Y元素的非金属性比W元素的非金属性强
1996年诺贝尔化学奖授于斯莫利等三位化学家,以表彰他们发现富勒烯(C60)开辟了化学研究的新领域。后来,人们又发现了一种含碳量极高的链式炔烃──棒碳,它是分子中含300-500个碳原子的新物质,其分子中只含有交替连接的单键和叁键。根据以上叙述回答8、9两小题:
6、下列说法中正确的是
A.含有非极性共价键的化合物分子一定是非极性分子
B.原子晶体中只存在非极性共价键
 C.冰是水分子通过氢键作用而形成的分子晶体
C.冰是水分子通过氢键作用而形成的分子晶体
D.若元素R的含氧酸的酸性大于元素Q的含氧酸的酸性,则非金属性R大于Q
5、下列性质的比较中,正确的是
A.熔点:Li>Na>K>Rb B.沸点:NH3<PH3<AsH3<SbH3
C.热稳定性:CH4>PH3>H2O>HF D.酸性:HClO>H2SO4>H3PO4>H2CO3
4、几种短周期元素的原子半径及主要化合价见下表:
|
元素代号 |
L |
M |
Q |
R |
T |
|
原子半径/nm |
0.160 |
0.143 |
0.102 |
0.089 |
0.074 |
|
主要化合价 |
+2 |
+3 |
+6、-2 |
+2 |
-2 |
下列叙述正确的是
A.L、M的单质与稀盐酸反应速率:M>L B.R的氧化物对应的水化物可能具有两性 C.T的气态氢化物分子间存在氢键 D.L、Q形成的简单离子核外电子数相等
3、同主族元素所形成的同一类化合物,往往结构与性质相似,化合物PH4I是一种无色晶体,下列对它的描述正确的是
A.它是一种共价化合物 B.充分加热,得到无色气体
C.这种化合物不能与氢氧化钠反应 D.该化合物可由HI和PH3化合而成
2、短周期的三种元素分别为X、Y和Z,已知X元素的原子最外层只有一个电子,Y元素原子的M电子层上的电子数是它的K层和L层电子总数的一半,Z原子的L层上的电子数比Y原子的L层上电子数少2个,则这三种元素所组成的化合物的分子式不可能是
A.X2YZ4 B.XYZ3 C.X3YZ4 D.X4Y2Z7
1、2007年10月24日19时12分,我国首颗月球探测卫星“嫦娥一号”发射成功,“嫦娥一号”的奔月之旅长达158万多公里,11月5号抵达环月轨道,成为环月卫星。”嫦娥”的任务之一是探测月壤厚度,从而估算核聚变发电燃料氦-3的含量、在月球上的分布情况。据估计,地球上可提取的氦-3不过15-20吨,可是月球上却可能有100万-500万吨。下列说法正确的是
A.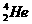 原子核内含有4个质子
B.
原子核内含有4个质子
B.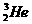 和
和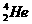 互为同位素
互为同位素
C.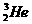 原子核内含有3个中子
D.核聚变反应中没有新元素生成
原子核内含有3个中子
D.核聚变反应中没有新元素生成
26.取一定量的Na2CO3和Na2SO4混合物溶液与过量的盐酸反应,生成2.016LCO2(标准状况下),然后加入足量的Ba(OH)2溶液,得到沉淀2.33g。试计算原混合物中Na2CO3和Na2SO4的物质的量分别为多少。
25.某河道两旁有甲乙两厂。它们排放的工业废水中,共含K+、Ag+、Fe3+、C1-、OH- 、NO3- 六种离子。甲厂的废水明显呈碱性,故甲厂废水中所含的三种离子 、 、 。 乙厂的废水中含有另外三种离子。
对于该两厂的废水,可采取下列两种方法来处理:
(1)如果在废水中加一定量 (选填:活性炭或铁粉),可以发生 反应,离子方程式是 ,并且能够回收其中的金属 (填写金属元素符号)。
(2)将甲厂和乙厂的废水按适当的比例混合,可以使废水中的某些离子转化为沉淀,写出两个离子方程式:
;
经过滤后的废水主要含 ,可用来浇灌农田。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com