
题目列表(包括答案和解析)
13、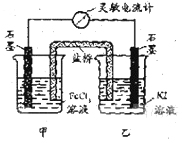 (09年福建理综·11)控制适合的条件,将反应2Fe3++2I-
(09年福建理综·11)控制适合的条件,将反应2Fe3++2I- 2Fe2++I2设计成如右图所示的原电池。下列判断不正确的是( )
2Fe2++I2设计成如右图所示的原电池。下列判断不正确的是( )
A.反应开始时,乙中石墨电极上发生氧化反应
B.反应开始时,甲中石墨电极上Fe3+被还原
C.电流计读数为零时,反应达到化学平衡状态
D.电流计读数为零后,在甲中溶入FeCl2固定,乙中石墨电极为负极
12、将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是( )
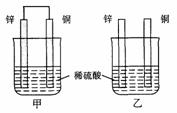 A.两烧杯中铜片表面均无气泡产生
A.两烧杯中铜片表面均无气泡产生
B.甲中铜片是正极,乙中铜片是负极
C.两烧杯中溶液的pH均增大
D.产生气泡的速度甲比乙慢
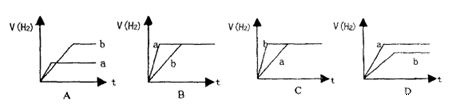
11、将等质量的两份锌粉a和b,分别加入两个盛过量的稀硫酸的烧杯中,并向加入a的烧杯中再加入少量CuO粉末。下列各图表示氢气体积V(H2)与反应时间t的关系,其中正确的是 ( )
10、锂电池是新型的高能电池,它以质轻、容量大而受到重视,目前已经制成多功能的锂电池。某种锂电池的总方程式可表示为:Li+MnO2→LiMnO2。若该电池提供0.5C电量,则消耗正极材料的质量约为(其他损耗忽略不计) ( )
A、3.5克 B、7克 C、4.52×10-4克 D、43.5克
9、锌与100mL1mol/L盐酸反应的实验中,若设想向溶液中加入少量的①醋酸钠,②溴化铜,③醋酸铜(均为可溶性),并测定生成H2的速率(mL/min),预计三种方案的速率大小是 ( )
A、①>③>② B、③>②>① C、②>③>① D、①>②>③
8、如下图所示的装置,在盛有水的烧坏中,铁圈和银圈的连接处吊着一根绝缘的
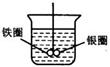 细丝,使之平衡.小心地从烧杯中央滴入CuSO4溶液.片刻后可观察到的现象是( )
细丝,使之平衡.小心地从烧杯中央滴入CuSO4溶液.片刻后可观察到的现象是( )
A.铁圈和银圈左右摇摆不定 B.保持平衡状态不变
C.铁圈向下倾斜 D.银圈向下倾斜
7、100 mL浓度为2 mol/L的盐酸跟过量的锌片反应,为加快反应速率,又不影响生成氢气的总量,可采用的方法是 ( )
A.加入适量的6 mol/L的盐酸 B.加入数滴氯化铜溶液 C.加入适量蒸馏水 D.加入适量的氯化钠溶液
6、某原电池总反应的离子方程式为:2Fe3++Fe=3Fe2+,不能实现该反应的原电池是 ( )
A:正极为Cu,负极为Fe,电解质为FeCl3溶液
B:正极为C,负极为Fe,电解质为Fe(NO3)3溶液
C:正极为Fe,负极为Zn,电解质为Fe2(SO4)3溶液
D:正极为Ag,负极为Fe,电解质为CuSO4 溶液
5、一个原电池的总反应的离子方程式是Zn+Cu2+=Zn2++Cu,该反应的原电池的正确组成是 ( )
|
|
A |
B |
C |
D |
|
正极 |
Zn |
Cu |
Zn |
Fe |
|
负极 |
Cu |
Zn |
Ag |
Zn |
|
电解质溶液 |
CuCl2 |
H2SO4 |
CuSO4 |
CuCl2 |
4、在用Zn、Cu片和稀H2SO4组成的原电池装置中,经过一段时间工作后,下列说法中正确的是( )
A. 锌片是正极,铜片上有气泡产生 C 电流方向是从锌片流向铜片
B. 溶液中H2SO4 的物质的量减少 D 电解液的pH保持不变
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com