
题目列表(包括答案和解析)
0.1 mol·L-1某一元酸HA在水中有0.1%发生电离,下列叙述错误的是 ( )
A.该溶液的pH = 4
B.升高温度,溶液的pH增大
C.此酸的电离平衡常数约为1×10-7
D.由HA电离出的c(H+)约为水电离出的c(H+)的106倍
5.(2009·海南化学卷,6)已知室温时,
4.(2009·广东卷,16)磷钨酸H3PW12O40等杂多酸可代替浓硫酸用于乙酸乙酯的制备。下列说法不正确的是 ( )
A.H3PW12O40在该酯化反应中起催化剂的作用
B.杂多酸盐Na2HPW12O40与Na3PW12O40都是强电解质
C.H3PW12O40、KH2PW12O40与Na3PW12O40含有相同的原子团
D.硅钨酸H4SiW12O40也是一种杂多酸,其中W的化合价为+8
3.(2007海南·08)下列溶液能与镁反应生成氢气的是 ( )
A.氯化铵溶液 B.氢氧化钠溶液
C.碳酸钾溶液 D.饱和石灰水
2.(2007海南·)下列叙述正确的是 ( )
A.95℃纯水的pH<7,说明加热可导致水呈酸性
B.pH=3的醋酸溶液,稀释至10倍后pH=4
C.0.2mol/L的盐酸,与等体积水混合后pH=1
D.pH=3的醋酸溶液,与pH=11的氢氧化钠溶液等体积混合后pH=7
1.(2008山东理综29)(12分)北京奥运会“祥云”火炬燃料是丙烷(C3H8)亚特兰大奥运会火炬燃料是丙烯(C3H6)
(1)丙烷脱氢可得丙烯。
已知:
则相同条件下,反应

(2)以丙烷为燃料制作新型烯料电池的正极通入O2和CO2,负极通入丙烷,电解质是熔融碳酸盐。电池反应方程式为 ;放电时,CO 移向电池的
移向电池的
(填“正”或“负”)极。
(3)碳氢化合物完全燃烧生成CO2和H2O。常温常压下,空气中的CO2溶于水,达到平衡时,溶液的pH=5.60,c(H2CO3)=1.5 mol·L-1。若忽略水的电离及H2CO3的第二级电离,则H2CO3
HC
mol·L-1。若忽略水的电离及H2CO3的第二级电离,则H2CO3
HC +H+的平衡常数K1=
。(已知:
+H+的平衡常数K1=
。(已知: )
)
(4)常温下,0.1 mol·L-1NaHC 溶液的pH大于8,则溶液中c(H2CO3)
c(C
溶液的pH大于8,则溶液中c(H2CO3)
c(C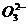 ),
),
(填“>”、“=”或“<” 原因是
(用离子方程式和必要的文字说明)。
原因是
(用离子方程式和必要的文字说明)。
7.答案:D
[解析]A选项,氢氧化钠和醋酸发生中和反应,反应放热,当酸反应完成后,再加碱,相当于往热水中加入冷水,温度降低,图意正确。B选项,醋酸中滴加氢氧化钠,酸性减弱,pH增大,滴定终点附近pH出现突跃,图意正确。C选项,醋酸中滴加氢氧化钠,相当于弱电解质变成强电解质,因此导电能力增加,图意正确。D选项,最初的NaOH都完全反应,当NaOH滴加一定量后曲线才会上扬,图意错误。
|

|
版权所有:()
版权所有:()
6.答案:AB
[解析]B项,pH(强酸)+pH(强碱) = 14,等体积混合时完全中和,正确。pH为1的硝酸中水电离出的c(H+)为10-13 mol/L,C项中两者之比为 = 1012,不正确。pH为3的硝酸中水电离出的c(H+)为10-11 mol/L,
= 1012,不正确。pH为3的硝酸中水电离出的c(H+)为10-11 mol/L, = 10-2,D项错。
= 10-2,D项错。
5.答案:D
[解析]加入NH3·H2O溶液,先和较强的HCl反应,离子的物质的量并未增加,但离子物质的量浓度减小,电导率下降;随后NH3·H2O和较弱的CH3COO反应,离子物质的量浓度增加,电导率上升;最后,加入NH2·H2O不再反应,对原溶液稀释,电导率略有下降。
4.答案: A
[解析]B项根据电荷守恒:c(Na+)+c(H+)=2c
(CO )+c(HCO
)+c(HCO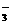 )+c(HO-),及物料守恒:c(Na+)=c(CO
)+c(HO-),及物料守恒:c(Na+)=c(CO )+c(HCO
)+c(HCO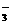 )+c(HCO3)
)+c(HCO3)
可导出:c(OH-)+c(H2CO3)-c(CO );C项,阴离子还有CO
);C项,阴离子还有CO 水解生成的H CO
水解生成的H CO ;D项等体积pH时,CH3COOH物质的量多,消耗 NaOH多。
;D项等体积pH时,CH3COOH物质的量多,消耗 NaOH多。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com