
题目列表(包括答案和解析)
6. 下列有关原电池和电解池的叙述中正确的是( )
A.钢管大部分浸在淡水中,主要发生析氢腐蚀
B.钢管若采用外加电流的阴极保护措施,应当与电源的正极相连
C.钢管若需保护,可采用牺牲阳极的阴极保护法
D.电解氯化钠溶液时电子从负极经过溶液流向正极( )
5、一种新型燃料电池,一极通入空气,另一极通入丁烷气体;电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在熔融状态下能传导O2-。下列对该燃料电池的说法不正确的是:( )
A、通入丁烷一极是负极,电极反应为:C4H10 + 26 OH- - 26 e- = 4CO2 + 18 H2O。
B、电池的总反应是:2C4H10 + 13 O2 → 8CO2 + 10 H2O
C、通入空气一极是正极,电极反应为:O2 + 4 e- = 2 O2-
D、在熔融电解质中,O2- 由正极移向负极
4、早在1807年化学家戴维用电解熔融氢氧化钠制得钠, 反应原理为: 4NaOH(熔融)=4Na+O2↑+2H2O;后来盖·吕萨克用铁与熔融氢氧化钠作用也制得钠,反应原理为:3Fe+4NaOH=Fe3O4+2H2↑+4Na↑。下列有关说法正确的是( )
 A、电解熔融氢氧化钠制钠,阳极发生电极反应为:2OH--2e-=H2↑+O2↑
A、电解熔融氢氧化钠制钠,阳极发生电极反应为:2OH--2e-=H2↑+O2↑
B、盖·吕萨克法制钠原理是利用铁的还原性比钠强
C、若戴维法与盖·吕萨克法制得等量的钠,则两反应中转移的电子总数也相同
D、目前工业上常用电解熔融氯化钠法制钠(如图),电解槽中石墨极为阳极,铁为阴极
3.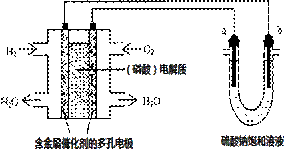 用酸性氢氧燃料电池电解硫酸钠饱和溶液的装置如图所示 (a、b为铜电极)。下列说法中不正确的是( )
用酸性氢氧燃料电池电解硫酸钠饱和溶液的装置如图所示 (a、b为铜电极)。下列说法中不正确的是( )
A.电池工作时,正极反应式为:
O2 +4H+ + 4e-= 2H2O
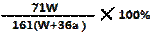 B.电解时,当阴极逸出amol气体,同时有W克Na2SO4﹒10H2O 析出,保持温度不变,剩余溶液中的硫酸钠的质量分数是
B.电解时,当阴极逸出amol气体,同时有W克Na2SO4﹒10H2O 析出,保持温度不变,剩余溶液中的硫酸钠的质量分数是
C.电解时,电子流动路径是:负极→外电路→阴极→溶液→阳极→正极
D.忽略能量损耗,当电池中消耗0.02g H2 时,b 极周围会产生0.02g H2
2.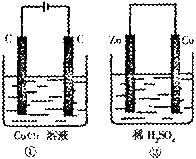 如图所示的两个实验装置中,溶液的体积均为200
mL,
如图所示的两个实验装置中,溶液的体积均为200
mL,
开始时电解质溶液的浓度均为0.1 mol/L,工作一段时间
后,测得导线中均通过0.02 mol电子,若不考虑气体的
溶解和溶液体积的变化,则下列叙述中正确的是( )
A.产生气体的体积:①>②
B.电极上析出物质的质量:①>②
C.溶液的pH变化:①增大,②减小
D.电极反应式:②中负极:Zn―2e―=Zn2+,①中阳极:Cu2++2e―=Cu
1.网易探索2010年5月20日报道,来自法国格勒诺布尔(Grenoble)约瑟夫·傅立叶大学的研究小组发明了第一块可为人体人造器官提供电能的可植入的葡萄糖生物燃料电池,其基本原理是葡萄糖和氧气在人体中酶的作用下发生的总反应为C6H12O6+6O2=6CO2+6H2O(酸性环境),下列对该电池说法不正确的是( )
A. 消耗1mol氧气则转移4mole-,H+会向正极移动
B. 电池的负极反应为:C6H12O6+6H2O-24e-=6CO2+24H+
C. 今后研究的研究方向是怎样提高葡萄糖生物燃料电池的效率,从而在将来达到可以利用葡萄糖生物燃料电池为任何可植入医疗设备提供电能
D. 该生物燃料电池可以在高温下工作
16.对于数以千万计的化学物质和为数更多的化学反应,分类法的作用几乎是无可替代的。
(1)现有下列六种物质:SO2、SiO2、CaO、MgO、Fe2O3、Na2O2,按照不同的分类标准,它们中有一种物质与其他五种有明显的不同,请找出这种物质,并写出分类的依据(至少要写出两种分类方法)。
①__________________________ ;
②__________________________ 。
(2)从反应中有无离子参加,可以将化学反应分为离子反应和非离子反应。Na2O2与水反应的离子方程式是__________________。从反应中________,可以将化学反应分为氧化还原反应和非氧化还原反应,从上述物质中分别找出两种能相互反应的物质,各写一个非氧化还原反应的方程式和氧化还原反应的方程式:______________________________、____________________________。
(3)虽然分类的方法不同,但离子反应和氧化还原反应之间也存在着一定的关系,请用简单的图示方法表示二者之间的关系。
答案:(1)①SO2,常温常压下是气体,其余为固体
②Na2O2,是过氧化物,其余为酸性氧化物或碱性氧化物
(2)2Na2O2+2H2O=4Na++4OH-+O2↑ 有无电子转移 CaO+SiO2 高温 CaSiO3(或MgO+SO2 △ MgSO3等其他合理答案) Na2O2+SO2=Na2SO4
(3) 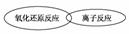 (意思正确、能表示二者的交叉关系即可)
(意思正确、能表示二者的交叉关系即可)
15.(2009·潍坊)A、B、C、D都是中学化学常见的物质,其中A、B、C均含有同一种元素。在一定条件下相互转化关系如图所示(部分产物已略去)。请按要求回答下列问题:
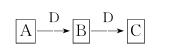
(1)若B、C为氧化物,B转化为C时,质量增加25%,则B转化为C的化学方程式是______________________________________。
(2)若D为某金属单质,向C的溶液中滴加硝酸银溶液,产生不溶于稀硝酸的白色沉淀,则B的化学式是________;将B的溶液加热蒸干再灼烧,得到的固体物质的化学式是________________。
(3)若D为强电解质溶液,A和C在溶液中反应生成白色沉淀B,则A和C反应的离子方程式是__________________________________________;符合条件的D物质可能是________(填序号)。
①硫酸 ②醋酸 ③氢氧化钠 ④一水合氨 ⑤氯化钡
解析:(1)由B、C是氧化物,可推知D为O2,则B、C是同种元素不同价态的氧化物,B转化为C时,质量增加25%,可推出A为S,B为SO2,C为SO3。(2)结合题中信息可知B、C为金属D的氯化物,结合转化关系,可推出D为变价金属Fe,故可推知A、B、C分别为:Cl2、FeCl3、FeCl2。(3)可推知A、C分别为Al3+(或AlO-2)与AlO-2(或Al3+),B是Al(OH)3;故A+C→B的离子方程式为:Al3++3AlO-2+6H2O=4Al(OH)3↓。由Al3+、AlO-2及Al(OH)3间的转化关系可推知D应是强酸或强碱,故符合条件的D可能是①、③。
答案:(1)

(2)FeCl3 Fe2O3
(3)Al3++3AlO-2+6H2O=4Al(OH)3↓ ①③
14.化工生产中常用到“三酸两碱”,“三酸”指硝酸、硫酸和盐酸,“两碱”指烧碱和纯碱。
(1)从物质的分类角度看,不恰当的一种物质是________(填物质名称)。
(2)“三酸”与“两碱”之间均可反应,若用化学方程式表示有六个(酸过量时),若用离子方程式表示却只有两个,请写出这两个离子方程式(酸过量时):
____________________、____________________。
(3)“三酸”常用于溶解金属和金属氧化物,下列块状金属在常温时能全部溶于足量浓硝酸的是________。
A.Au B.Cu
C.Al D.Fe
(4)烧碱、纯碱溶液均可吸收CO2,当含0.1 mol NaOH的溶液吸收一定量CO2后,将溶液低温小心蒸干得到固体的组成可能有四种情况,分别是(填化学式):
①________,②Na2CO3,③________,④NaHCO3
(5)将得到的固体重新溶解于水,向其中加入盐酸,调节溶液的pH恰好等于7,再将溶液蒸干,最终得到固体的质量为________g。
答案:(1)纯碱 (2)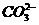 +2H+=CO2↑+H2O
+2H+=CO2↑+H2O
OH-+H+=H2O
(3)B
(4)①NaOH,Na2CO3 ③Na2CO3,NaHCO3
(5)5.85
13.(2009·福州)下列逻辑关系图示中正确的是( )
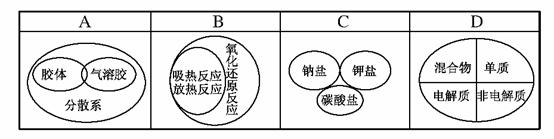
解析:解答本题的关键是理解物质的分类标准。根据分散质粒子直径的大小将分散系分为溶液、胶体和浊液;而气溶胶属于胶体的一种,故A错误。氧化还原反应与吸热反应和放热反应的分类标准不同,故B错误。钾盐与钠盐是根据盐中的阳离子进行分类的,碳酸盐是根据盐中阴离子进行分类的,故C错误。
答案:D
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com