
题目列表(包括答案和解析)
2.(2010·邯郸摸底考试)对H2O的电离平衡不产生影响的微粒是( )
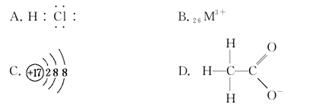
解析:选项A,HCl抑制H2O的电离;选项B,Fe3+水解促进H2O的电离;选项C,Cl-对H2O的电离无影响;选项D,CH3COO-水解促进H2O的电离。
答案:C
1.(2010·石家庄质检(一))下列表达方式正确的是( )

解析:A项,二氧化碳是直线形分子,不正确;B项,正确;C项,N2的电子式应为 ,故不正确;D项,质量数为37的氯原子应表示为
,故不正确;D项,质量数为37的氯原子应表示为 ,故不正确。
,故不正确。
答案:B
15.(2010·南昌市调研)各写出一个符合下列要求的化学方程式或离子方程式:
Ⅰ.某化学反应可用下式表示:A+B―→C+D+H2O
(1)若A、C、D均含有氯元素,且A的化合价介于C、D之间,写出该反应的离子方程式:__________________________________。
(2)若A和B是主要由第二周期元素组成的物质,C、D均为气体,且其中一种为有色气体,写出其反应的化学方程式:______________________________。
Ⅱ.一定量Cl2通入FeI2溶液中,完全反应后测得溶液中c(Fe3+)=c(Fe2+),写出其反应的离子方程式:__________________________________。
解析:Ⅰ.(1)根据价态,说明A自身发生氧化还原反应,且是同一种元素的价态发生变化。可以联想中学哪些元素是多价态,然后可以写出氯气与氢氧化钠溶液反应的方程式。(2)依据题意,可以围绕非金属元素C、N、O、F等思考,由此联想到碳与浓硝酸的反应。Ⅱ.氯气先氧化I-,再氧化Fe2+,由题意可知,一半的Fe2+被氧化,说明I-完全被氧化,根据量的关系可以写出反应的离子方程式。
答案:Ⅰ.(1)Cl2+2OH-===Cl-+ClO-+H2O
(2)C+4HNO3(浓)CO2↑+4NO2↑+2H2O
Ⅱ.5Cl2+2Fe2++8I-===10Cl-+2Fe3++4I2
14.(2010·四川省诊断性测试)如下图所示的转化关系中(部分产物省略),A是由四种短周期元素组成的正盐,X是黄绿色气体,D、F都是无色有刺激性气味的气体;气体I对H2的相对密度是13,且分子中各原子处于同一直线上;D、E分子都是10电子微粒。
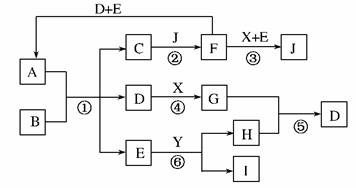
请回答下列问题:
(1)J的化学式为________,Y的电子式为________。
(2)反应③的离子方程式是________________,反应⑤的化学方程式是________________。
(3)上述转化中,属于氧化还原反应的是(填编号)________。
(4)在450℃、催化剂存在下,4 mol F和2 mol O2反应放热353.9 kJ,此时,F的转化率为90%,则该反应的热化学方程式为__________________________。
解析:由X是黄绿色气体可知,X是Cl2,由D是10电子微粒且D是无色有刺激性气味的气体,那么D为NH3,气体I对H2的相对密度是13,M(I)=26,且分子中各原子处于同一直线上,那么I为乙炔。由I为乙炔可以逆推出:E为H2O,Y为CaC2。F是无色有刺激性气味的气体,那么可推出F为SO2。由SO2与Cl2和H2O反应生成J,那么J可能为HCl或H2SO4。反应⑤的化学方程式是利用Ca(OH)2来制备氨气,反应③为SO2与Cl2和H2O反应,是氧化还原反应,反应④是Cl2与NH3反应生成NH4Cl,也是氧化还原反应。
答案:(1)HCl或H2SO4 Ca2+[?: C⋮⋮C?: ]2-
(2)SO2+Cl2+2H2O===SO+2Cl-+4H+
2NH4Cl+Ca(OH)2CaCl2+2NH3↑+2H2O
(3)③④ (4)2SO2(g)+O2(g) 2SO3(g);ΔH=-196.6
kJ·mol-1
2SO3(g);ΔH=-196.6
kJ·mol-1
13.(2010·武汉市武昌区调研)实验室制取氯气的方法很多,通常有如下三种:
(1)用二氧化锰与浓盐酸共热制取氯气。如果将过量二氧化锰与20 mL 12 mol/L的浓盐酸混合加热,充分反应后生成的氯气明显少于0.06 mol。产生该结果的主要原因是:①________________,②________________。
(2)高锰酸钾与浓盐酸反应可制取氯气,其反应的化学方程式为:________________________________。若消耗0.1 mol氧化剂,则被氧化的还原剂的物质的量为________mol。
(3)氯酸钾晶体与浓盐酸反应可用于制取氯气,该反应中氧化产物和还原产物的物质的量之比为________。现按如下操作进行有关氯气的制备及性质实验:在一片下衬白纸的圆形玻璃片上(如图),A点滴一滴0.1 mol/L KI溶液,B点滴一滴FeSO4溶液(含KSCN),C点滴一滴NaOH溶液(含酚酞),O点放少量KClO3晶体。向KClO3晶体上滴加一滴浓盐酸,立即用表面皿盖好。试回答下列问题:
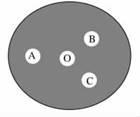
①A点反应的离子方程式为__________________;
②B点的现象为________________;
③C点的溶液由红色变为无色,是因为中和褪色还是漂白而褪色,请你设计实验证明之______________________________________________________。
解析:(1)二氧化锰氧化浓盐酸制取氯气,随着反应的进行,浓盐酸不断挥发和消耗,浓盐酸逐渐变为稀盐酸,反应停止进行,因此制取的氯气的实际值比理论值小。(2)高锰酸钾氧化浓盐酸制取氯气的反应为:2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O,根据方程式,2 mol KMnO4参加反应,充当还原剂的HCl为10 mol,因此消耗0.1 mol氧化剂,被氧化的还原剂为0.5 mol。
(3)根据
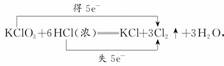
氧化产物和还原产物的物质的量之比为5?1。①A点发生KI和Cl2的反应:2I-+Cl2===I2+2Cl-;②B点氯气将Fe2+氧化为Fe3+,Fe3+遇SCN-变为血红色;③中和褪色是次氯酸和盐酸使溶液不再呈碱性所致;漂白褪色是由于次氯酸将红色漂白。前者酚酞依然存在,后者酚酞已被破坏,故只需滴加NaOH溶液观察溶液是否再出现红色即可。
答案:(1)①加热使氯化氢大量挥发 ②盐酸变稀后不再发生反应 (2)2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O 0.5 (3)5?:1 ①Cl2+2I-===2Cl-+I2 ②溶液由浅绿色变为血红色 ③向C点褪色后的溶液中再滴加NaOH溶液,若溶液变为红色,则为中和褪色;若溶液不变为红色,则是漂白而褪色
12.(2010·南昌市调研)一定量CO2通入某浓度的NaOH溶液得溶液A,向A溶液中逐滴滴入稀盐酸,加入n(HCl)与生成n(CO2)的关系如图所示。下列有关叙述正确的是( )
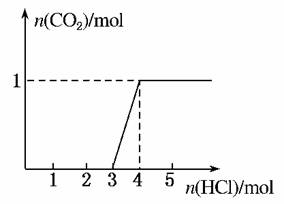
A.通入的CO2气体在标准状况下可能大于22.4 L
B.A溶液中n(NaOH)=2n(Na2CO3)
C.A溶液中既含Na2CO3,又含NaHCO3
D.A溶液中一定只有Na2CO3
解析:根据碳酸钠与盐酸的反应情况:
①Na2CO3+HCl===NaHCO3+NaCl;
②NaHCO3+HCl===NaCl+CO2↑+H2O。
开始滴入3 mol 盐酸无气体生成,后滴入1 mol盐酸,生成1 mol CO2,而后再滴加盐酸无气体生成,说明A溶液为氢氧化钠与碳酸钠的混合物,根据上述化学反应机理,可以推断A溶液中碳酸钠为1 mol,氢氧化钠为2 mol。
答案:B
11.(2010·黄冈市质检)将足量NH3通入HNO3和AgNO3的混合溶液中,生成沉淀的物质的量(n)和通入NH3的体积(V)关系(如图所示)正确的是( )
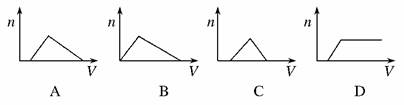
解析:NH3通入硝酸和硝酸银的混合溶液中,先与硝酸反应,故开始没有沉淀,等硝酸全部反应完全后,再与硝酸银反应产生氢氧化银沉淀,再通氨气会生成可溶性的银氨溶液,故沉淀又会减少,直至最终没有沉淀,反应方程式为:NH3+HNO3===NH4NO3,NH3+AgNO3+H2O===AgOH↓+NH4NO3,AgOH+2NH3===Ag(NH3)2OH(银氨溶液),结合消耗NH3的量,故选A,不选C。
答案:A
10.(2010·苏北四市调研)A、B、C、D、E都是中学化学中常见物质,它们均含有同一种短周期元素,在一定条件下可发生如图所示的转化,其中A是单质,B在常温下是气态氢化物,C、D是氧化物,E是D和水反应的产物。下列判断中不合理的是( )
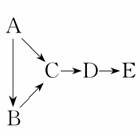
A.A不可能是金属
B.由C生成D肯定发生了电子转移
C.A生成C肯定属于离子反应
D.B和E可能会发生反应生成一种盐
解析:根据图示转化关系,B为A的气态氢化物,因此A不可能为金属,A对;根据C、D为A的不同氧化物,则由C生成D为氧化还原反应,B对;根据图示关系,A有变价氧化物,可以推断A可能为N2、S等,此时A生成C的反应为单质和氧气的反应,肯定不是离子反应,C错;当A为N2时,B为NH3、E为HNO3,NH3与HNO3反应生成NH4NO3,D对。
答案:C
9.(2009·安徽)酸性氧化物是中学阶段常见的一类物质,能够发生许多化学反应,下列有关酸性氧化物的性质正确的是( )
A.二氧化硅和强碱的反应中,二氧化硅表现出了氧化性
B. 镁可在二氧化碳中燃烧,产物为氧化镁和碳,反应过程中二氧化碳表现出了氧化性
C. 二氧化硫使溴水褪色的过程中,二氧化硫表现出了漂白性
D. 二氧化氮溶于水的反应中,二氧化氮只表现出了氧化性
解析:二氧化硅与碱反应,元素化合价没有发生变化,是非氧化还原反应;镁在二氧化碳中燃烧时产物中有碳,碳元素的化合价降低,二氧化碳表现出了氧化性;二氧化硫与溴发生了氧化还原反应,使溴水褪色并不是漂白过程;二氧化氮溶于水生成了硝酸和一氧化氮,既表现了氧化性,又表现了还原性。
答案:B
8.(2009·北京东城模拟)由于浓硫酸具有多重特性--强烈的吸水性、脱水性与强氧化性,在中学化学实验中经常用浓硫酸制取气体,在以下几个实验中,使用的硫酸采用较高浓度的原因不是基于上述特性的是( )
A.在实验室利用Na2SO3与硫酸制取SO2气体时,一般采用浓度较大的硫酸
B.在制取乙烯的实验中使用浓硫酸作催化剂
C.以浓硫酸与甲酸(HCOOH)制取CO气体
D.利用金属Cu与浓硫酸反应制取SO2气体
解析:制备SO2气体采用较高浓度的H2SO4,主要利用硫酸的酸性;①加快发生反应SO+2H+===SO2↑+H2O,②使化学平衡SO2+H2O⇌H2SO3⇌H++HSO向逆反应方向进行,降低SO2的溶解度,A符合题意;制备乙烯和CO都是利用了浓H2SO4的脱水性、吸水性,而利用Cu与浓H2SO4反应制备SO2则是利用了浓H2SO4的强氧化性,B、C、D皆不符合题目要求,本题答案为A。
答案:A
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com