
题目列表(包括答案和解析)
12.(2010·襄樊市调研)将一定量的镁和铜组成的混合物加入到稀硝酸中,金属完全溶解(假设反应中还原产物只有NO)。向反应后的溶液中加入3 mol/L NaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加5.1 g。则下列叙述中不正确的是( )
A.当生成的沉淀量达到最大时,消耗NaOH溶液的体积V≥100 mL
B.当金属全部溶解时收集到NO气体的体积一定为2.24 L
C.参加反应的金属的总质量为9.6 g>m>3.6 g
D.当金属全部溶解时,参加反应的硝酸的物质的量一定是0.4 mol
解析:沉淀增加的质量为OH-的质量,则n(OH-)==0.3 mol,因此当沉淀量达到最大时,消耗NaOH溶液的体积最少为=0.1 L,A对;根据Cu(OH)2、Mg(OH)2,则n(Cu)+n(Mg)=n(OH-)=0.15 mol,根据得失电子守恒,有2n(Cu)+2n(Mg)=3n(NO),则n(NO)=0.15 mol×2×=0.1 mol,则收集到NO的体积在标准状况下为2.24 L,B错;假设混合物全部为Mg,则金属总质量为0.15 mol×24 g·mol-1=3.6 g,假设混合物全部为Cu,则金属总质量为0.15 mol×64 g·mol-1=9.6 g,故参加反应的金属的总质量为9.6 g>m>3.6 g,C对;Mg和Cu与稀硝酸的反应可以写为3M+8HNO3===3M(NO3)2+2NO↑+4H2O,参加反应的n(HNO3)=4n(NO)=0.4 mol,D对。
答案:B
11.(2010·武汉市武昌区调研)将一定量的铜粉加入到100 mL某浓度的稀硝酸中,充分反应后,容器中剩有m1g的铜粉,此时共收集到NO气体448 mL(标准状况)。然后向上述混合物中加入足量稀硫酸至不再反应为止,容器剩有铜粉m2g,则(m1-m2)为( )
A.5.76 B.2.88
C.1.92 D.0
解析:根据3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,充分反应后溶液中n(NO)=3n(NO)=×3=0.06 mol。再加入足量稀硫酸,根据3Cu+8H++2NO===3Cu2++2NO↑+4H2O,溶解的n(Cu)=n(NO)=×0.06 mol=0.09 mol,故m1-m2=64×0.09=5.76。
答案:A
10.(2010·武汉市武昌区调研)右图中横坐标为加入反应物的物质的量,纵坐标为产生沉淀的物质的量。下列选项编号对应的曲线编号错误的是( )
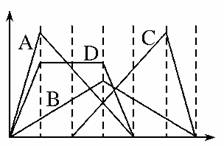
A.向NaAlO2溶液中逐滴加入盐酸至过量
B.向澄清石灰水中通入CO2至过量
C.向含有盐酸的AlCl3溶液中滴入NaOH溶液至过量
D.向含有等物质的量的Ca(OH)2、KOH的混合溶液中通入CO2至过量
解析:根据AlO+H++H2O===Al(OH)3↓、Al(OH)3+3H+===Al3++3H2O,A对;根据Ca(OH)2+CO2===CaCO3↓+H2O、CaCO3+CO2+H2O===Ca(HCO3)2,B对;根据H++OH-===H2O、Al3++3OH-===Al(OH)3↓、Al(OH)3+OH-===AlO+2H2O,C对;D项中产生沉淀和沉淀的量不变时消耗的CO2相等,D错。
答案:D
9.(2010·江西省联考)将15.6 g Na2O2和5.4 g Al同时放入一定量的水中,充分反应后得到200 mL溶液,再向该溶液中缓慢通入标准状况下的HCl气体6.72 L,若反应过程中溶液的体积保持不变,则下列说法正确的是( )
A.反应过程中能得到6.72 L的气体(标准状况下)
B.最终得到的溶液中c(Na+)=c(Cl-)+c(OH-)
C.最终得到15.6 g的沉淀
D.最终得到的溶液中c(NaCl)=1.5 mol/L
解析:由题意可知n(Na2O2)=0.2 mol,n(Al)=0.2 mol,发生反应:2Na2O2+2H2O===4NaOH+O2↑,2Al+2NaOH+2H2O===2NaAlO2+3H2↑,可知生成气体0.4 mol,标准状况下体积为8.96 L;通入的HCl气体先和过量的NaOH反应,剩余0.1 mol HCl和NaAlO2反应生成0.1 mol Al(OH)3:NaAlO2+HCl+H2O===NaCl+Al(OH)3↓,得到沉淀的质量为7.8 g,最终溶液中含有0.3 mol NaCl、0.1 mol NaAlO2,故A、B、C错误。
答案:D
8.(2010·石家庄质检(一))下列图象表示Al3+与AlO物质的量变化的曲线,实线表示Al3+,虚线表示AlO,其中正确的是( )

解析:根据反应Al3++3OH-===Al(OH)3↓和Al(OH)3+OH-===AlO+2H2O中消耗OH-的关系可知图象B正确;由AlO+H++H2O===Al(OH)3和Al(OH)3+3H+===Al3++3H2O知C、D错。
答案:B
7.(2010·四川省检测)将4 mol金属Al全部转化为Al(OH)3,共计消耗HCl a mol,NaOH b mol,则(a+b)的最小值为( )
A.4 B.6
C.8 D.16
解析:由铝制氢氧化铝时最省原料的方案是利用双水解:AlCl3+3NaAlO2+6H2O===3NaCl+4Al(OH)3↓,由原子守恒知,利用铝制备4 mol Al(OH)3需要3 mol HCl和3 mol NaOH。
答案:B
6.(2010·北京市东城区检测)锌与100 mL 18.5 mol·L-1的浓硫酸充分反应后,锌完全溶解,同时生成气体甲33.6 L(标准状况)。将反应后的溶液稀释至1 L,测得溶液的pH=1,下列叙述不正确的是( )
A.反应中共消耗1.8 mol H2SO4
B.气体甲中SO2与H2的体积比为4?1
C.反应中共消耗97.5 g Zn
D.反应中共转移3 mol电子
解析:反应前n(H2SO4)=1.85 mol,反应后剩余H2SO4为0.05 mol,推知气体甲应该是Zn与浓H2SO4反应产生的SO2及Zn与稀H2SO4反应产生的H2的混合气体。设生成SO2、H2的物质的量分别为x mol、y mol,则有:x+y=1.5,根据反应:Zn+2H2SO4(浓)===ZnSO4+SO2↑+2H2O,Zn+H2SO4(稀)===ZnSO4+H2↑,得2x+y=1.8,解得x=0.3,y=1.2。n(SO2)/n(H2)=0.3 mol/1.2 mol=1/4。反应中消耗Zn的质量=1.5 mol×65 g/mol=97.5 g。反应中转移电子的物质的量=2×1.5 mol=3 mol。综合上述知选项B错误。
答案:B
5.(2010·湖北省八校联考)CO2与H2的混合气体5 g,在150℃时和足量的氧气混合,用电火花充分引燃,在相同状况下再将反应后所得混合气体通入到足量的Na2O2中,测得Na2O2固体增重的质量为3.4 g,则原混合气体中CO2的物质的量分数为( )
A.25% B.75%
C.88% D.32%
解析:根据反应:2CO2+2Na2O2===2Na2CO3+O2①;2H2+O22H2O②;2H2O+2Na2O2===4NaOH+O2③,由②+③则有:2Na2O2+2H2===4NaOH④。设CO2为x mol,则其质量为44x g,H2的质量=(5-44x)g,根据差值法,反应①增重28x g,反应④增重(5-44x)g,则有:5-44x+28x=3.4,解得x=0.1,故CO2质量为4.4 g,其物质的量分数=×100%=25%。
答案:A
4.(2010·赣州市质检)下列各组中两种浓溶液相混合时既无沉淀析出又无气体放出的是( )
A.Ba(HCO3)2、NaHSO4 B.NaHCO3、Al2(SO4)3
C.Mg(HCO3)2、CaCl2 D.Na2SiO3、HCl
解析:A项中反应为Ba(HCO3)2+2NaHSO4===Na2SO4+BaSO4↓+2H2O+2CO2↑,既有沉淀产生,又有气体放出;B项中反应为Al3++3HCO===Al(OH)3↓+3CO2↑,既有沉淀产生,又有气体放出;D项中SiO+2H+===H2SiO3↓,有沉淀产生。
答案:C
3.(2010·江西省联考)将等体积、等pH的NaOH溶液和氨水,分别全部加入到甲、乙烧杯中。下列说法正确的是( )
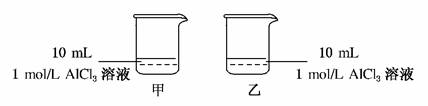
A.甲中沉淀一定比乙多
B.乙中沉淀一定比甲多
C.甲中沉淀可能比乙多
D.甲和乙中沉淀可能一样多
解析:NaOH溶液可以溶解Al(OH)3,而NH3·H2O不能溶解Al(OH)3。等体积、等pH的NaOH溶液和氨水,显然n(NH3·H2O)>n(NaOH),当n(NaOH)≤3n(Al3+)时,甲和乙中沉淀一样多;当n(NaOH)>3n(Al3+)时,甲中沉淀比乙少;不可能出现甲中沉淀比乙多的情况。
答案:D
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com