
题目列表(包括答案和解析)
15.(10分)(2009·上海,24)某反应中反应物与生成物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X。
(1)已知KBrO3在反应中得到电子,则该反应的还原剂是________。
(2)已知0.2 mol KBrO3在反应中得到1 mol电子生成X,则X的化学式为__________。
(3)根据上述反应可推知__________(填序号)。
a.氧化性:KBrO3>H3AsO4
b.氧化性:H3AsO4>HBrO3
c.还原性:AsH3>X
d.还原性:X>AsH3
(4)将氧化剂和还原剂的化学式及其配平后的系数填入下列方框中,并标出电子转移的方向和数目。
+
14.(10分)传统的自来水处理剂是在自来水中加入规定剂量的液氯,液氯能够溶解于水,并且与水能够发生化学反应。近年来,科技工作者为了延长液氯的杀菌时间,在液氯中加入适量的液氨。
(1)请你写出液氯与水反应的化学方程式:____________________________________,
氧化剂是__________,还原剂是________。从氧化剂和还原剂来看,该反应的特点是________________________________________________________________________,
从元素化合价的变化来看,该反应的特点是_______________________________。
(2)用液氯作为自来水的杀菌剂,起作用的是HClO,所以液氯加入水中后含氯的物质有氯单质、HClO和________,其中氯单质可以从水中挥发,这正是我们有时打开自来水管能够闻到刺激性气味的原因,HClO也可以分解产生氧气和HCl。在液氯中加入少量液氨,生成NH2Cl,NH2Cl比HClO稳定。在HClO浓度大的时候发生的反应是NH3+HClO===H2O+NH2Cl,在HClO浓度小的时候发生的反应是H2O+NH2Cl===NH3↑+HClO,所以这种方法可以缓慢的放出HClO,起杀菌、消毒的作用,减少了氯的流失。以上两个反应的反应类型是__________(填序号)。
A.氧化还原反应 B.非氧化还原反应
C.置换反应 D.复分解反应
13.(12分)某校化学实验兴趣小组在“探究卤素单质的氧化性”的系列实验中发现:在足量的稀氯化亚铁溶液中,加入1-2滴溴水,振荡后溶液呈黄色。
(1)提出问题:Fe3+、Br2哪一个的氧化性更强?
(2)猜想
①甲同学认为氧化性:Fe3+>Br2,故上述实验现象不是发生化学反应所致,则溶液呈黄色是含________(填化学式,下同)所致。
②乙同学认为氧化性:Br2>Fe3+,故上述实验现象是发生化学反应所致,则溶液呈黄色是含__________所致。
(3)设计实验并验证
丙同学为验证乙同学的观点,选用下列某些试剂设计出两种方案进行实验,并通过观察实验现象,证明了乙同学的观点确实是正确的。供选用的试剂:
a.酚酞试液 b.CCl4 c.无水酒精 d.KSCN溶液
请你在下列表格中写出丙同学选用的试剂及实验中观察到的现象。(试剂填序号)
|
|
选用试剂 |
实验现象 |
|
方案1 |
|
|
|
方案2 |
|
|
(4)应用与拓展
①在足量的稀氯化亚铁溶液中加入1-2滴溴水,溶液呈黄色,所发生的离子反应方程式为_______________________________________________________________________。
②在100 mL FeBr2溶液中通入2.24 L Cl2(标准状况),溶液中有1/3的Br-被氧化成单质Br2,则原FeBr2溶液中FeBr2的物质的量浓度为_________________________________。
12.用高铁酸钠(Na2FeO4)对河湖水消毒是城市饮水处理的新技术。已知反应Fe2O3+3Na2O2===2Na2FeO4+Na2O,下列说法正确的是 ( )
A.Na2O2既是氧化剂又是还原剂
B.Fe2O3在反应中得到电子
C.3 mol Na2O2发生反应,有12 mol e-转移
D.Na2FeO4能消毒杀菌是因其具有强氧化性
11.根据以下实验事实,判断四种微粒在酸性条件下,氧化性由强到弱的顺序是( )
①向FeCl3溶液中滴加KI溶液,再加入CCl4振荡,CCl4层呈紫红色 ②向FeCl2溶液中加入氯水,再加入KSCN溶液呈红色 ③向KMnO4溶液中加入浓盐酸后,振荡后紫色褪去
A.I2>Cl2>Fe3+>MnO B.MnO>Cl2>Fe3+>I2
C.Cl2>I2>Fe3+>MnO D.Fe3+>MnO>Cl2>I2
10.在KClO3+6HCl(浓)===KCl+3Cl2↑+3H2O反应中,氧化剂与还原剂的物质的量之比为 ( )
A.1∶6 B.1∶5 C.6∶1 D.5∶1
9.三氟化氮(NF3)是微电子工业中优良的等离子刻蚀气体,它在潮湿的环境中能发生反应:3NF3+5H2O===2NO+HNO3+9HF。下列有关该反应的说法正确的是 ( )
A.NF3在潮湿的空气中泄漏会产生红棕色气体
B.NF3是氧化剂,H2O是还原剂
C.还原剂与氧化剂的物质的量之比为2∶1
D.若生成0.2 mol HNO3,则转移0.2 mol电子
8.在淀粉碘化钾溶液中加入少量次氯酸钠溶液,并加入少量的稀硫酸,溶液立即变蓝,在上述溶液中加入足量的亚硫酸钠溶液,蓝色逐渐消失。下列判断不正确的是( )
A.氧化性:ClO->I2>SO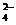
B.漂白粉溶液可使淀粉碘化钾试纸变蓝
C.向氯水中加入亚硫酸钠溶液,氯水褪色
D.次氯酸钠可以与亚硫酸钠共存
7.奥运会上发令枪所用“火药”的主要成分是氯酸钾和红磷,撞击时发生的化学反应为5KClO3+6P===3P2O5+5KCl。下列有关该反应的叙述,正确的是 ( )
A.反应中红磷是氧化剂
B.发令时产生的白烟只有KCl固体颗粒
C.“火药”中的红磷可用白磷代替
D.反应中消耗3 mol P时,转移电子的物质的量为15 mol
6.做实验时不小心使皮肤上粘了一些高锰酸钾,形成的黑斑很久才能消除,如果用草酸(乙二酸)的稀溶液洗涤,黑斑可以迅速褪去,其离子方程式为:
 MnO+C2O+H+
CO2↑+Mn2++□。下列有关叙述正确的是
( )
MnO+C2O+H+
CO2↑+Mn2++□。下列有关叙述正确的是
( )
A.发生还原反应的是C2O
B.该离子方程式右侧方框内的产物是OH-
C.10 mol H+参加反应时,电子转移5 mol
D.1 mol草酸分子中含有9 mol共用电子对
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com