
题目列表(包括答案和解析)
16.(1)①2H++2e-―→H2↑ 有气体放出,溶液变红 Na+、H+
②2Cl-―→Cl2↑+2e- 把湿润的淀粉碘化钾试纸放在Y电极附近,试纸变蓝色,说明生成了Cl2
(2)①纯铜 Cu2++2e-―→Cu
②粗铜 Cu―→Cu2++2e- ③变小
(3)Zn2++2e-―→Zn ZnCl2 ZnSO4(答案不惟一,合理即可)
15.(1)①a+b b/t ②氨水
(2)①VO+2H++e-―→VO2++H2O ②绿 紫
③参与正极反应 通过交换膜定向移动使电流通过溶液 0.5 mol
14.(1)负 (2)增大 减小 不变 (3)0.025 mol/L (4)13
13. (1)PbO2+ +4H++2e-―→PbSO4+2H2O 小
48
(1)PbO2+ +4H++2e-―→PbSO4+2H2O 小
48
(2)Pb PbO2 对换
11.B 12.B
16.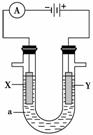 (14分)电解原理在化学工业中有广泛的应用。
(14分)电解原理在化学工业中有广泛的应用。
右图表示一个电解池,装有电解液a;X、Y是两块电极板,通
过导线与直流电源相连。请回答以下问题:
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则:
①电解池中X极上的电极反应式为_____________________________________________,
在X极附近观察到的现象是________________________________________________。
电解液中向X极方向移动的离子是 。
②Y电极上的电极反应式为___________________________________________________,
检验该电极反应产物的方法是_________________________________________________
________________________________________________________________________。
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则:
①X电极的材料是________,电极反应式为__________________________。
②Y电极的材料是________,电极反应式为_____________________________________。
③溶液中的c(Cu2+)与电解前相比________(填“变大”、“变小”或“不变”)。
(3)如利用该装置实现铁上镀锌,电极X上发生的反应为________________________,电解池盛放的电镀液可以是________或________(只要求填两种电解质溶液)。
答案 1.C 2.C 3.C 4.C 5.B 6.A 7.B 8.C 9.D 10.B
15.(10分)(2010·重庆理综,29)钒(V)及其化合物广泛应用于工业催化、新材料和新能源等领域。
(1)V2O5是接触法制硫酸的催化剂。
①一定条件下,SO2与空气反应t min后,SO2和SO3物质的量浓度分别为a mol/L和
b mol/L,则SO2起始物质的量浓度为____________mol/L;生成SO3的化学反应速率为____________mol/(L·min)。
②工业制硫酸,尾气SO2用__________吸收。
(2)全钒液流储能电池是利用不同价态离子对的氧化还原反应来实现化学能和电能相互转化的装置,其原理如下图所示。
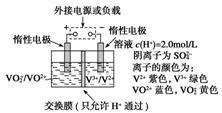
①当左槽溶液颜色逐渐由黄变蓝,其电极反应式为_________________________________
________________________________________________________________________。
②充电过程中,右槽溶液颜色逐渐由____________色变为________色。
③放电过程中氢离子的作用是______________________和____________________;充电时若转移的电子数为3.01×1023个,左槽溶液中n(H+)的变化量为________。
14.(8分)在如图所示的装置中,若通入直流电5 min时,铜电极质量增加2.16 g。试回答:
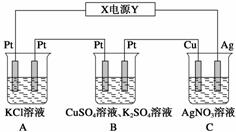
(1)电源中X电极为直流电源的__________极。
(2)pH变化:A:________,B:________,C:________(填“增大”、“减小”或“不变”)。
(3)通电5 min时,B中共收集224 mL气体(标况),溶液体积为200 mL,则通电前CuSO4溶液的物质的量浓度为____________(设电解前后溶液体积无变化)。
(4)若A中KCl溶液的体积也是200 mL,电解后,溶液的pH为__________(设电解前后溶液体积无变化)。
13.(8分)铅蓄电池是典型的可充电电池,它的正负极极板是惰性材料,电池总反应式为:
 Pb+PbO2+4H++2SO放电充电2PbSO4+2H2O
Pb+PbO2+4H++2SO放电充电2PbSO4+2H2O
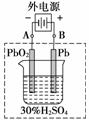
请回答下列问题(不考虑氢、氧的氧化还原):
(1)放电时,正极的电极反应式是
________________________________________________________________________;
电解液中H2SO4的浓度将变__________;当外电路通过1 mol电子时,理论上负极板的质量增加________ g。
(2)在完全放电耗尽PbO2和Pb时,若按上图连接,电解一段时间后,则在A电极上生成________,B电极上生成__________,此时铅蓄电池的正负极的极性将_______________。
12.某同学按右图所示的装置进行电解实验。下列说法正确的是 ( )

A.电解过程中,铜电极上有H2产生
B.电解初期,主反应方程式为:Cu+H2SO4CuSO4+H2↑
C.电解一定时间后,石墨电极上无铜析出
D.整个电解过程中,H+的浓度不断增大
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com