
题目列表(包括答案和解析)
1.(2010·武汉市武昌区调研)下列实验中所选用的仪器或操作合理的是( )
A.用托盘天平称量5.85 g氯化钠晶体
B.用湿润pH试纸测定某H2SO4溶液的pH
C.可用酸式滴定管量取25.00 mL高锰酸钾溶液
D.用瓷坩埚灼烧碳酸钠晶体
解析:托盘天平只能精确到0.1 g,因此用托盘天平不能称量5.85 g氯化钠,A错;测定溶液的pH时,将pH试纸湿润相当于稀释待测溶液,则测定H2SO4溶液时实验结果偏大,B错;酸式滴定管精确到0.01 mL,可以用酸式滴定管量取25.00 mL高锰酸钾溶液,C对;瓷坩埚中含有SiO2,高温时能与碳酸钠发生反应:Na2CO3+SiO2Na2SiO3+CO2↑,D错。
答案:C
16.(2010·山东卷)聚合硫酸铁又称聚铁,化学式为[Fe2(OH)n(SO4)3-0.5n]m,广泛用于污水处理。实验室利用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁和绿矾(FeSO4·7H2O),过程如下:
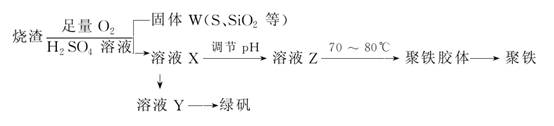
(1)验证固体W焙烧后产生的气体含有SO2的方法是____________________________。
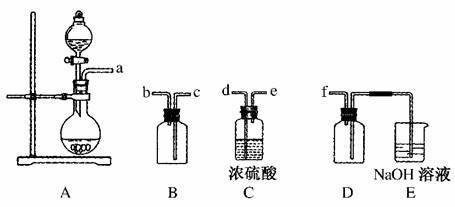
(2)实验室制备、收集干燥的SO2,所需仪器如下。装置A产生SO2,按气流方向连接各仪器接口,顺序为a→______________________→f。装置D的作用是________,装置E中NaOH溶液的作用是________。
(3)制备绿矾时,向溶液X中加入过量________,充分反应后,经________操作得到溶液Y,再经浓缩、结晶等步骤得到绿矾。
(4)溶液Z的pH影响聚铁中铁的质量分数,用pH试纸测定溶液pH的操作方法为______________________。若溶液Z的pH偏小,将导致聚铁中铁的质量分数偏__________________。
解析:本题以元素化合物为载体,意在考查考生的综合实验能力。
(1)检验SO2气体可选用品红试液、溴水或酸性KMnO4溶液。
(2)生成的SO2先通过C装置干燥,然后经B装置用排空气法收集,最后连接装置D,显然装置D作安全瓶,防倒吸,而E中NaOH溶液用于吸收尾气。
(3)根据聚铁的化学式可知铁元素的化合价为+3,由此可推知溶液X中主要含Fe3+,因此在制绿矾时,应向溶液X中加入过量的铁屑,经过滤操作即得FeSO4溶液。
(4)若pH太小,酸性太强,则Fe3+不易沉淀生成聚铁,故铁的质量分数偏小。
答案:(1)将气体通入品红溶液,溶液褪色,加热恢复原色(合理即得分)
(2)d→e→c→b 防止倒吸 吸收多余的SO2
(3)铁屑 过滤
(4)将小片pH试纸放在点滴板(或表面皿)上,用玻璃棒蘸取少量待测液点在试纸上,与标准比色卡对照 低(小)
15.(2010·四川省德阳市“一诊”考试)现有A、B、C、D、E分别为Al2(SO4)3、AgNO3、Ba(OH)2、K2CO3、HCl五种强电解质中的一种。已知:
①A、B溶液呈碱性;C、D、E溶液呈酸性。
②A溶液与E溶液反应既有气体又有沉淀产生;A溶液与C溶液反应只有气体产生。
③D溶液与另外四种溶液反应都能产生沉淀;C只能与D反应产生沉淀。(注:沉淀包括微溶物)
请回答下列问题:
(1)B的化学式为________________。
(2)E中阳离子的结构示意图为________________。
(3)检验A中阳离子所用的方法是__________________。
(4)A溶液与E溶液反应的离子方程式为________________________。
解析:根据①可知,A、B为Ba(OH)2、K2CO3,C、D、E为HCl、AgNO3、Al2(SO4)3。根据②并结合①推知A为K2CO3,E为Al2(SO4)3,C为HCl。根据③并结合①②可推知D为AgNO3,B为Ba(OH)2。根据K+的焰色反应可鉴别出K+。Al3+与CO在溶液中发生双水解反应生成Al(OH)3、CO2;2Al3++3CO+3H2O===2Al(OH)3↓+3CO2↑。
答案:(1)Ba(OH)2 (2) 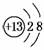 (3)焰色反应
(3)焰色反应
(4)3CO+2Al3++3H2O===2Al(OH)3↓+3CO2↑
14.(2010·唐山市联考)教材中经常利用如图装置进行有关物质的制备和性质检验。

(1)请按要求填充下表空格:
|
实验名称 |
选用的仪器(填字母) |
C或D中所盛试剂(填名称) |
C或D中的现象 |
|
区别固体Na2CO3和NaHCO3 |
BD |
澄清石灰水 |
|
|
铜和浓硫酸反应 |
AC |
|
溶液红色褪去 |
|
制备乙酸乙酯 |
|
饱和碳酸钠溶液 |
上层有透明油状液体产生并有香味 |
(2)针对上述实验下列说法正确的是(填写字母代号)________。
A.Cu和浓硫酸反应时,可在装置C的试管口塞沾有碱液的棉花
B.加热装置C中已吸收Cu和浓硫酸反应生成物后的溶液不能出现红色
C.制备乙酸乙酯时,装置C的导管末端在液面以下
D.装置B可用于制备氨气
解析:(1)碳酸氢钠受热分解产生二氧化碳,二氧化碳遇澄清石灰水生成白色的CaCO3沉淀而使澄清石灰水变浑浊;根据现象“溶液红色褪去”及铜与浓硫酸反应的产物可知加入的试剂为品红溶液;实验室中制备乙酸乙酯的反应物为液体,所以选用装置A作为反应器,用装置C作为产物乙酸乙酯的接收装置及除杂装置。
(2)铜与浓硫酸反应容易逸出有毒气体二氧化硫,该气体可以溶解在碱液中,所以可以用沾有碱液的棉花吸收,A正确;品红溶液吸收二氧化硫生成不稳定的无色物质,加热可以释放出二氧化硫,品红溶液恢复红色,B错;为了防止倒吸,制备乙酸乙酯时,装置C的导管不能插入吸收液中,C错;装置B是加热固体反应物的装置,故可以加入铵盐与碱的混合物制备氨气,D正确。
答案:(1)
|
|
|
|
|
|
|
|
|
澄清石灰水变浑浊 |
|
|
|
品红溶液 |
|
|
|
AC |
|
|
(2)AD
13.(2010·全国卷Ⅰ)有A、B、C、D、E和F六瓶无色溶液,它们都是中学化学中常用的无机试剂。纯E为无色油状液体;B、C、D和F是盐溶液,且它们的阴离子均不同。现进行如下实验:
①A有刺激性气味,用蘸有浓盐酸的玻璃棒接近A时产生白色烟雾;
②将A分别加入其他五种溶液中,只有D、F中有沉淀生成;继续加入过量A时,D中沉淀无变化,F中沉淀完全溶解;
③将B分别加入C、D、E、F中,C、D、F中产生沉淀,E中有无色、无味气体逸出;
④将C分别加入D、E、F中,均有沉淀生成 ,再加入稀HNO3,沉淀均不溶。
根据上述实验信息,请回答下列问题:
(1)能确定的溶液是(写出溶液标号与相应溶质的化学式):__________________________________________;
(2)不能确定的溶液,写出其标号、溶质可能的化学式及进一步鉴别的方法:_____________________________________。
解析:本题主要考查物质的推断,意在考查考生的逻辑推理能力。由A有刺激性气味,且与浓盐酸靠近有白雾,说明A为浓氨水。而F能溶于过量的氨水,说明其为AgNO3溶液。纯E为油状液体,故E为H2SO4。由C与E(H2SO4)和F(AgNO3)要产生不溶于硝酸的沉淀故其为BaCl2或BaBr2等。B与H2SO4反应生成无色无味的气体,说明其含CO,但阳离子不能确定。故可以确定的是:A为浓氨水,F为AgNO3溶液,E为H2SO4。
答案:(1)A NH3 E H2SO4 F AgNO3 C BaCl2
(若C作为不能确定的溶液,进一步鉴别的方法合理,同样给分)
(2)B Na2CO3或K2CO3 用铂丝蘸取少量B,在酒精灯火焰中灼热,若焰色呈黄色则B为Na2CO3溶液;若透过蓝色钴玻璃观察焰色呈紫色,则B为K2CO3溶液
D Al2(SO4)3或MgSO4 取少量D,向其中滴加NaOH溶液有沉淀生成,继续加过量NaOH溶液,若沉淀溶解,则D为Al2(SO4)3溶液,若沉淀不溶,则D为MgSO4溶液
12.(2010·武汉市武昌区调研)某无色溶液中含有:①Na+、②Ba2+、③Cl-、④Br-、⑤SO、⑥SO中的一种或几种,依次进行下列实验,且每步所加试剂均过量,观察到的现象如下:
|
步骤 |
操作 |
现象 |
|
① |
用pH试纸检验 |
溶液的pH大于7 |
|
② |
向溶液中滴加氯水,再加入CCl4振荡,静置 |
CCl4层呈橙色 |
|
③ |
向②所得溶液中加入Ba(NO3)2溶液和稀HNO3 |
有白色沉淀产生 |
|
④ |
过滤,向滤液中加入AgNO3溶液和稀HNO3 |
有白色沉淀产生 |
下列结论正确的是( )
A.肯定含有的离子是①④⑤
B.肯定没有的离子是②⑤
C.可能含有的离子是①②⑥
D.不能确定的离子是①③⑥
解析:根据步骤②,说明加入氯水后有Br2生成,则原溶液中一定含有Br-;根据步骤③,说明步骤②所得溶液中有SO,则原溶液中至少含有SO、SO中的一种;步骤④,说明步骤②、步骤③所得溶液中有Cl-,由于步骤②中加入氯水引入了Cl-,则不能确定原溶液中是否含有Cl-;结合①,溶液显碱性,则一定含有SO,SO无法确定;由于Ba2+不能与SO、SO共存,则原溶液中一定不含Ba2+,根据电荷守恒,则原溶液中一定含有Na+。因此肯定含有的离子是①④⑤,肯定没有的离子是②,不能确定的离子是③⑥。
答案:A
11.(2010·邯郸市摸底考试)用试纸检验气体性质是一种重要的实验方法。如图所示的实验中(可加热),下列试纸的选用、现象、对应结论都正确的一项是( )

|
选项 |
试剂B |
湿润的试纸A |
现象 |
结论 |
|
A |
碘水 |
淀粉试纸 |
变蓝 |
碘具有氧化性 |
|
B |
浓氨水,生石灰 |
蓝色石蕊试纸 |
变红 |
氨气为碱性气体 |
|
C |
Na2SO3,硫酸 |
品红试纸 |
褪色 |
SO2具有漂白性 |
|
D |
Cu,浓硝酸 |
KI淀粉试纸 |
变蓝 |
NO2为酸性气体 |
解析:选项A,碘水中的I2与淀粉作用出现蓝色,与I2的氧化性无关。选项B,NH3遇红色石蕊试纸变蓝,证明NH3是一种碱性气体。选项C,Na2SO3与H2SO4反应产生SO2,SO2使品红试纸褪色,证明SO2具有漂白性。选项D,Cu与浓HNO3反应产生NO2,NO2氧化I-生成的I2与淀粉作用变蓝,证明NO2具有氧化性而不是酸性。
答案:C
10.(2010·四川省德阳市“一诊”考试)现有①K2SO4;②Ba(NO3)2;③Al2(SO4)3;④KOH;⑤CuCl2五种物质的溶液。不用其他任何试剂就能把它们鉴别出来,其鉴别出来的顺序是( )
A.⑤④③②① B.②③④①⑤
C.⑤④①②③ D.①②③④⑤
解析:首先根据CuCl2溶液的颜色鉴别出CuCl2溶液,再用CuCl2溶液鉴别出KOH,用KOH鉴别出Al2(SO4)3,用Al2(SO4)3鉴别出Ba(NO3)2,最后鉴别出K2SO4。
答案:A
9.(2010·北京市海淀区期末)下列做法正确的是( )
A.蒸干FeCl3溶液得到FeCl3固体
B.用稀硝酸除去Cu粉中混有的CuO
C.将工业乙醇蒸馏得到96.5%的乙醇
D.用BaCl2除去NaOH溶液中混有的少量Na2SO4
解析:蒸干FeCl3溶液的过程中,FeCl3发生水解:FeCl3+3H2OƒFe(OH)3+3HCl,由于HCl挥发,最终得到Fe(OH)3固体,A错;稀硝酸既能溶解CuO,也能溶解Cu,应选择稀盐酸或稀硫酸除去Cu粉中混有的CuO,B错;除去NaOH溶液中混有的少量Na2SO4,选择BaCl2除去Na2SO4的同时引入了NaCl,应选择Ba(OH)2,D错。
答案:C
8.(2010·湖北省八校联考)下列有关实验描述中,正确的是( )
A.检验溴乙烷中的溴元素:在溴乙烷中滴入氢氧化钾溶液加热后,用稀硝酸酸化再滴加硝酸银溶液
B. 测氯水的pH,可用玻璃棒蘸取氯水点在pH试纸上, 待其变色后和标准比色卡比较
C. 配制一定物质的量浓度溶液时,用量筒量取溶液的体积时仰视读数,所得溶液的浓度偏低
D. 证明CH2===CHCH2CHO中一定有碳碳不饱和键:滴入KMnO4酸性溶液,看紫红色是否褪去
解析:选项A,CH3CH2Br在KOH溶液中水解后,需加入HNO3中和掉KOH,防止加入AgNO3时生成Ag2O沉淀而干扰实验,正确。选项B,由于氯水具有强氧化性,用pH试纸测定其pH时,出现先变红后褪色的现象,无法测其pH。选项C,仰视读数导致所取液体体积偏大,结果偏高。选项D,由于-CHO也能使酸性KMnO4溶液褪色,无法确定其是否含有碳碳双键。
答案:A
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com