
题目列表(包括答案和解析)
6.(2010·沪州市摸底考试)在两个恒容的密闭容器中进行下列两个可逆反应:(甲)C(s)+H2O(g)⇌CO(g)+H2(g);(乙)CO(g)+H2O(g)⇌CO2(g)+H2(g)。现有下列状态:①混合气体平均相对分子质量不再改变 ②恒温时,气体压强不再改变 ③各气体组分浓度相等 ④断裂氢氧键的速率等于断裂氢氢键速率的2倍 ⑤混合气体密度不变 ⑥单位时间内,消耗水蒸气的质量与生成氢气的质量比为9:1 ⑦同一时间内,水蒸气消耗的物质的量等于氢气消耗的物质的量,其中能表明甲、乙容器中反应都达到平衡状态的是( )
A.①②⑤ B.③④⑥
C.①⑥⑦ D.④⑦
解析:甲容器中,碳为固态,该可逆反应属于气体体积不相等的反应;乙容器中,反应属于等气体分子数的反应,气体相对分子质量、密度、压强都始终不变,①②⑤错误;各组分浓度相等,不能判断反应是否都达到了平衡状态,③错误。断裂氢氧键速率等于断裂氢氢键速率的2倍,经转化得,氢氧键的断裂速率等于生成氢氧键的速率,④正确;消耗水蒸气与生成氢气是同一反应方向,⑥错误;消耗氢气的物质的量等于同时生成水蒸气的物质的量,经转化得消耗氢气的物质的量等于生成氢气的物质的量,⑦正确。
答案:D
5.(2010·武汉市武昌区调研)一定条件下,在体积为10 L的密闭容器中,1 mol X和1 mol Y进行反应:2X(g)+Y(g)⇌Z(g),经60 s达到平衡,生成0.3 mol Z,下列说法正确的是( )
A.以X浓度变化表示的反应速率为0.001 mol/(L·s)
B.将容器体积变为20 L,Z的平衡浓度为原来的1/2
C.若增大压强,则物质Y的转化率减小
D.若升高温度,X的体积分数增大,则该反应的ΔH>0
解析:以Z表示的反应速率为v(Z)==0.0005 mol/(L·s),根据同一反应中不同物质表示的反应速率之比等于化学计量数之比,则v(X)=2v(Z)=0.001 mol/(L·s),A对;将容器体积变为20 L,则压强减小,平衡向逆反应方向移动,Z的物质的量减小,则Z的平衡浓度小于原来的1/2,B错;增大压强,平衡向正反应方向移动,Y的转化率增大,C错;升高温度,X的体积分数增大,说明平衡向逆反应方向移动,而升高温度平衡向吸热反应方向移动,则正反应为放热反应,ΔH<0,D错。
答案:A
4.(2010·北京市抽样)已知:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g);ΔH=-49.0 kJ·mol-1。一定条件下,向体积为1 L的密闭容器中充入1 mol CO2和3 mol H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如图所示。下列叙述中,正确的是( )
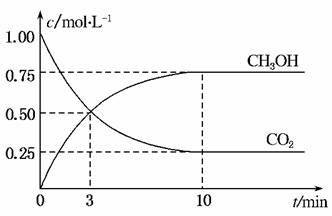
A.升高温度能使增大
B.反应达到平衡状态时,CO2的平衡转化率为75%
C.3 min时,用CO2的浓度表示的正反应速率等于用CH3OH的浓度表示的逆反应速率
D.从反应开始到平衡,H2的平均反应速率v(H2)=0.075 mol·L-1·min-1
解析:该反应ΔH<0,为放热反应,升高温度,平衡向逆反应方向移动,n(CH3OH)减小,n(CO2)增大,减小,A错;反应达平衡时,CO2的转化率为×100%=75%,B对;3 min时,c(CH3OH)=c(CO2),由于3 min后c(CH3OH)增大,c(CO2)减小,即v正>v逆,因此用CO2的浓度表示的正反应速率大于用CH3OH的浓度表示的逆反应速率,C错;0-10 min内,v(CO2)==0.075 mol·L-1·min-1,根据同一反应中用不同物质表示的反应速率之比等于化学计量数之比,v(H2)=3v(CO2)=0.225 mol·L-1·min-1,D错。
答案:B
3.(2010·南昌市调研)已知NO2与N2O4可相互转化:2NO2(g)⇌N2O4(g);ΔH=-24.2 kJ/mol,在恒温下,将一定量NO2和N2O4(g)的混合气体充入体积为2 L的密闭容器中,其中物质的浓度随时间变化的关系如下图所示。下列推理分析合理的是( )
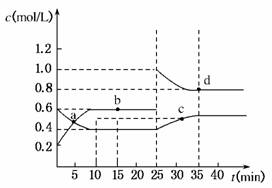
A.前10 min内,用v(NO2)表示的反应速率为0.02 mol/(L·min)
B.反应进行到10 min时,体系吸收的热量为9.68 kJ
C.a、b、c、d四点中v正与v逆均相等
D.25 min时,导致平衡移动的原因是升温
解析:根据反应达平衡后物质的浓度之比,可知初始反应浓度增加的曲线表示NO2变化曲线,前10 min内,v(NO2)=0.04 mol/(L·min);反应进行到10 min时,生成NO2 0.8 mol,吸收热量为9.68 kJ;a、b、c、d四点中只有b和d两点位于平衡状态,只有该两点正、逆反应速率相等;25 min时导致平衡移动的原因是增加NO2的浓度。,答案:B
2.(2010·赣州市质检)用纯净的碳酸钙与稀盐酸反应制取二氧化碳气体。下列措施对改变该反应的速率几乎没有影响的是( )
A.用相同浓度但温度较高的盐酸代替常温下的盐酸
B.增大反应体系的压强或减小反应体系的压强
C.改用相同质量但为粉末状态的碳酸钙代替块状碳酸钙
D.改用与原盐酸含有相同H+浓度的稀硫酸
解析:温度高,反应速率提高;压强是通过改变气体的浓度来改变化学反应速率的,而该反应为固体碳酸钙与液体盐酸的反应,反应物中没有气体,故改变压强对该反应的速率几乎没有影响;粉末状态的固体表面积大,反应速率快;尽管强调了稀硫酸与原盐酸中的H+浓度相同,但硫酸与碳酸钙反应生成的CaSO4微溶,覆盖在碳酸钙表面,从而使碳酸钙与H+的接触面积减小,导致反应速率变慢。
答案:B
1.(2009·广州)下列有关化学反应速率的认识,正确的是( )
A.增大压强(对于气体反应),活化分子总数增大,故反应速率增大
B.温度升高,分子动能增加,减小了活化能,故反应速率增大
C.选用适当的催化剂,分子运动加快,增加了碰撞频率,故反应速率增大
D.H+和OH-的反应活化能接近于零,反应几乎在瞬间完成
解析:增大压强,体积减小,活化分子总数不变,但活化分子浓度增大,反应速率增大,A不正确。温度升高,更多分子吸收能量成为活化分子,反应速率增大,活化能不变,B不正确。使用催化剂,降低活化能,使更多分子成为活化分子,反应速率增大,C不正确。
答案:D
14.(2010·郑州市质量预测)常温下,向100 mL 0.01 mol·L-1HA溶液中逐滴加入0.02 mol·L-1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计)。回答下列问题:

(1)由图中信息可知HA为________酸(填“强”或“弱”),理由是________________________________________________________________________。
(2)常温下一定浓度的MA稀溶液的pH=a,则a________7(填“>”、“<”或“=”),用离子方程式表示其原因为________________________________________________________________________;,此时,溶液中由水电离出的c(OH-)=________。,(3)请写出K点所对应的溶液中离子浓度的大小关系:_________________________________________,________________________________________________________________________。
(4)K点对应的溶液中,c(M+)+c(MOH)________2c(A-)(填“>”、“<”或“=”);若此时溶液中,pH=10,则c(MOH)+c(OH-)=________mol·L-1。
解析:由题目信息可知0.01 mol/L HA溶液,pH=2,说明其完全电离,故为强电解质。由题目图象可知100 mL 0.01 mol/L HA溶液中滴加51 mL 0.02 mol/L MOH溶液,pH=7,说明MOH是弱碱,故其对应的MA是弱碱强酸盐,水解显酸性,溶液中H+全部是水电离出来的,故水电离出的c(OH-)=1×10-amol·L-1。在K点是100 mL 0.01 mol/L HA溶液中滴加100 mL 0.02 mol/L MOH溶液反应,反应后的溶液为等浓度的MA和MOH溶液,故c(M+)>c(A-)>c(OH-)>c(H+)。由物料守恒可得c(M+)+c(MOH)=2c(A-),结合电荷守恒:c(M+)+c(H+)=c(A-)+c(OH-),c(MOH)+c(OH-)=c(A-)+c(H+)≈0.005 mol·L-1。
答案:(1)强 0.01 mol·L-1HA的pH为2,说明HA完全电离
(2)< M++H2OMOH+H+,1×10-amol·L-1,(3)c(M+)>c(A-)>c(OH-)>c(H+),(4)= 0.005,15.某化学实验小组从商店买回的浓硫酸试剂标签的部分内容如图所示。由于试剂瓶口密封签已破损,他们怀疑该硫酸的质量分数与标签不符,决定开展研究。,硫酸:化学纯(CP) 品名:硫酸,化学式:H2SO4 相对分子质量:98,质量分数:98% 密度:1.98 g/cm3,甲同学认为,可以用一种精密仪器测量该溶液的c(H+),若c(H+)=36.8 mol·L-1,则该溶液的质量分数为98%。,乙同学认为,即使有精密的仪器,甲同学的方案也不行,建议用重量分析法来测定。具体设想:取一定体积的该硫酸与足量氯化钡溶液反应,过滤、洗涤、干燥沉淀,称量沉淀的质量。,丙同学则建议用中和滴定法进行测定,设想如下:①准确量取一定体积的硫酸,用适量的水稀释;②往稀释后的溶液中滴入几滴指示剂;③用碱式滴定管量取标准浓度的氢氧化钠溶液滴定,直到出现滴定终点为止;④记录消耗的氢氧化钠溶液的体积。,请回答下列问题:,(1)乙同学推测甲同学的方案不可行的理由是________________________________________________________________________,________________________________________________________________________。
(2)乙同学的方案的关键操作有两点:①确保SO完全沉淀;②洗涤沉淀,确保沉淀不含杂质。在实际中,洗涤沉淀的操作方法是________________________________________________________________________,________________________________________________________________________;,设计简单实验检验SO是否完全沉淀:________________________________________________________________________,________________________________________________________________________。
(3)在丙同学的方案中步骤②用到的指示剂是________;达到滴定终点的标志是________________________________________________________________________。
(4)丙同学的方案中,下列操作对测定结果的影响无法确定的是________。,①在滴定前未用NaOH标准溶液润洗滴定管,②滴定前滴定管尖嘴部分有气泡,滴定后滴定管尖嘴部分仍有气泡,③锥形瓶用蒸馏水洗净后,没有用待测液润洗,④滴定前,仰视读数,滴定后,仍仰视读数,⑤滴定前,仰视读数,滴定后俯视读数
(5)丙同学在实验中,分别取等体积原硫酸,用NaOH溶液滴定三次,终点时,得到的NaOH溶液体积如下表所示:,
|
实验序号 |
硫酸体积 |
NaOH溶液体积 |
NaOH溶液浓度 |
|
① |
5.00 mL |
35.65 mL |
5.00 mol·L-1 |
|
② |
5.00 mL |
39.65 mL |
5.00 mol·L-1 |
|
③ |
5.00 mL |
35.55 mL |
5.00mol·L-1 |
通过计算,确认该浓硫酸质量分数与标签是否相符?________(填“相符”或“不相符”),理由是________________________________________________________________________,________________________________________________________________________。
答案:(1)浓硫酸含水少,硫酸主要以分子形式存在
(2)通过玻璃棒引流,向过滤器中注入蒸馏水,浸没沉淀,待水流出后,再注入蒸馏水,重复多次直到沉淀洗净为止 在上层清液中滴加氯化钡(或硝酸钡等)溶液,若产生白色沉淀,则说明SO没有完全沉淀;若不产生白色沉淀,则说明SO已完全沉淀
(3)酚酞试液 无色变成粉红色,且半分钟内不褪色,(4)②④,(5)不相符 舍去误差大的数据(VNaOH=39.65 mL),可得==35.60 mL,根据标签数据计算得浓硫酸的物质的量浓度为c(H2SO4)= mol·L-1=19.8mol·L-1,根据中和滴定测得浓硫酸的浓度为c(H2SO4)=mol·L-1=17.8mol·L-1<19.8mol·L-1,,
13.(2010·江西省联考)某温度(T)下的溶液中,c(H+)=10-xmol·L-1,c(OH-)=10-ymol·L-1,x与y的关系如图所示,请回答下列问题:,(1)此温度下,水的离子积KW为________,则该温度T________25℃(填“>”、“<”或“=”),pH=7的溶液显________性(填“酸”、“碱”或“中”)。,(2)若将此温度(T)下,pH=11的苛性钠溶液a L与pH=1的稀硫酸b L混合(假设混合后溶液体积的微小变化忽略不计),试通过计算填写以下不同情况时两种溶液的体积比。,①若所得混合液为中性,则a?b=________;,②若所得混合液的pH=2,则a?b=________。
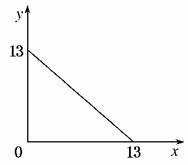
解析:(1)当x=0时,y=13,水的离子积KW=c(H+)×c(OH-)=1×10-13>1×10-14,故该温度T>25℃;pH=7的溶液中,c(H+)=1×10-7mol·L-1<c(OH-)=1×10-6mol·L-1,故溶液显碱性。(2)此温度(T)下,pH=11的苛性钠溶液中,c(OH-)=1×10-2mol·L-1,pH=1的稀硫酸中,c(H+)=1×10-1mol·L-1。若所得混合液为中性,则c(OH-)×a L=c(H+)×b L,a?b=10?1;若所得混合液的pH=2,则[c(H+)×b L-c(OH-)×a L]/(a+b)L=1×10-2mol·L-1,解得:a?b=9?2。
答案:(1)1×10-13 > 碱 (2)①10:1 ②9:2
12.浓度均为0.1 mol·L-1的三种溶液:①CH3COOH溶液,②氢氧化钠溶液 ③醋酸钠溶液,下列说法不正确的是( )
A.①和②等体积混合后的溶液中:c(OH-)=c(H+)+c(CH3COOH)
B.①和③等体积混合后溶液显酸性:c(CH3COO-)>c(Na+)>c(H+)>c(OH-),C.②和③等体积混合后溶液中由水电离出的c(H+)<10-7 mol/L,D.由水电离出的c(OH-):②>③>①,解析:①和②等体积混合后的溶液为醋酸钠溶液,根据质子守恒知A选项正确;①和③等体积混合后溶液呈酸性,醋酸的电离程度大于CH3COONa的水解程度,因此离子浓度为c(CH3COO-)>c(Na+)>c(H+)>c(OH-),B选项正确;②和③等体积混合后水的电离受到抑制,由水电离出的c(H+)<10-7 mol/L,C选项正确;由水电离出的c(OH-):③>①>②,D选项错误。
答案:D
11.(2010·上海卷)下列溶液中微粒浓度关系一定正确的是( )
A.氨水与氯化铵的pH=7的混合溶液中:c(Cl-)>c(NH)
B.pH=2的一元酸和pH=12的一元强碱等体积混合:c(OH-)=c(H+)
C.0.1 mol·L-1的硫酸铵溶液中:c(NH)>c(SO)>c(H+)
D.0.1 mol·L-1的硫化钠溶液中:c(OH-)=c(H+)+c(HS-)+c(H2S)
解析:本题考查离子浓度的大小比较,意在考查考生的分析能力。氨水与氯化铵混合溶液的pH=7,则c(H+)=c(OH-),根据电荷守恒:c(H+)+c(NH)=c(OH-)+c(Cl-),则c(NH)=c(Cl-),A项错误;pH=2的一元酸和pH=12的一元强碱等体积混合,若一元酸为强酸,则二者恰好完全反应,溶液显中性,c(H+)=c(OH-),若一元酸为弱酸,则一元酸剩余,溶液显酸性,c(H+)>c(OH-),B项错误;0.1 mol/L的(NH4)2SO4溶液中由于NH水解,溶液显酸性,离子浓度大小为c(NH)>c(SO)>c(H+)>c(OH-),C项正确;0.1 mol/L的Na2S溶液中,根据电荷守恒:c(Na+)+c(H+)=2c(S2-)+c(HS-)+c(OH-)…①,根据物料守恒:c(Na+)=2(c(S2-)+c(HS-)+c(H2S))…②,将②代入①,消去c(Na+),则c(H+)+c(HS-)+2c(H2S)=c(OH-),D项错误。
答案:C
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com