
题目列表(包括答案和解析)
2.下列实验方案合理的是( )
A.用湿润的pH试纸测定某盐溶液的pH
B.用稀硫酸清洗长期存放氯化铁溶液的试剂瓶内壁所附着的不溶物
C.用加热法分离I2和NH4Cl的混合物
D.为了快速得到氢气,可以用纯锌代替粗锌
解析:A项,用pH试纸测定溶液pH时不能先润湿,否则可能引起较大误差;B项,长期存放FeCl3溶液的试剂瓶内壁所附着的不溶物是Fe(OH)3,可用稀H2SO4清洗;C项,I2易升华,NH4Cl受热易分解成HCl和NH3,故不能用加热法分离;D项要加快生成H2的速率,应用粗锌代替纯锌,即利用原电池原理加快反应速率.
答案:B
1.(2010·海淀模拟)下列实验操作正确的是( )
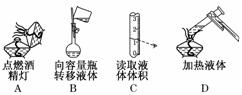
解析:不能用已燃着的酒精灯点燃另一只酒精灯,A错;读取溶液体积时,视线应与液体的凹液面相平,C错;加热液体时,要用酒精灯的外焰加热,D错.
答案:B
5.(2010·天津高考,有改动)纳米 TiO2在涂料、光催化、化妆品等领域有着极其广泛的应用.
TiO2在涂料、光催化、化妆品等领域有着极其广泛的应用.
制备纳米TiO2的方法之一是TiCl4水解生成TiO2·xH2O,经过滤、水洗除去其中的
Cl-,再烘干,焙烧除去水 分得到粉体TiO2.
分得到粉体TiO2.
用现代分析仪器测定TiO2粒子的大小,用氧化还原滴定法测定TiO2的质量分数;一定条件下,将TiO2溶解并还原为Ti3+,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+.
请回答下列问题:
(1)TiCl4水解生成TiO2·xH2O的化学方程式为________________________________.
(2)检验TiO2·xH 2O中Cl-是否被除净的方法是________________________________.
2O中Cl-是否被除净的方法是________________________________.
(3)配制NH4Fe(SO4)2标准溶液时,加入一定量H2SO4的原因是________________;使用 的仪器除天平、药匙、玻璃棒、烧杯、量筒外,还需要下图中的________(填字母代号).
的仪器除天平、药匙、玻璃棒、烧杯、量筒外,还需要下图中的________(填字母代号).

(4)滴定终点的现象是_______________________________________________________.
(5)滴定分析时,称取TiO2(摩尔质量为M g·mol-1)试样w g,消耗c mol·L-1 NH4Fe(SO4)2标准溶液V mL,则TiO2质量分数表达式为________________.
(6)判断下列操作对TiO2质量分数测定结果的影响(填“偏高”、“偏低”或“无影响”).
①若在 配制标准溶液过程中,烧杯中的NH4Fe(SO4)2溶液有少量溅出,使测定结果________.
配制标准溶液过程中,烧杯中的NH4Fe(SO4)2溶液有少量溅出,使测定结果________.
②若在滴定终点读取滴定管刻度时,俯视标准液液面,使测定结果________.
解析:(1)根据盐类水解规律可知,Ti4+结合水电离的OH-形成TiO2的水合物,根据元素守恒不难写出相应的反应方程式.
(2)水解后的溶液为HCl溶液,故TiO2·xH2O表面吸附了Cl-,可通过检验洗涤液中是否存在Cl-确定沉淀是否洗涤干净.
(3)NH4Fe(SO4)2的阳离子均水解,溶液呈酸性,故可以通过加H2SO4抑制它们的水解,防止所配溶液出现浑浊.容量瓶用于配制一定体积的溶液,滴管可以用来定容.
(4)达到滴定终点时,Fe3+与SCN-反应使溶液变为红色.
(5)根据元素守恒和电子守恒可知,有如下转化关系式:
TiO2-Ti3+-NH4Fe(SO4)2
M 1 mol
m cV/1 000
m=McV/1 000,故TiO2的质量分数为:(或%).
(6)从计算式可知,①所配浓度实际偏小,消耗溶液的体积偏大,使测定结果偏高.②俯视滴定管读数偏小,使测定结果偏低.
答案:(1)TiCl4+(x+2)H2O TiO2·xH2O↓+4HCl
TiO2·xH2O↓+4HCl
(2)取少量水洗液,滴加AgNO3溶液,不产生白色沉淀,说明Cl-已除净
(3)抑制NH4Fe(SO4)2的水解 ac
(4)溶液变为红色
(5)(或%)
(6)①偏高 ②偏低
[发展等级评价]
(限时45分钟,满分100分)
4.(2010·上海高考)正确的实验操作是实验成功的重要因素,下列实验操作错误的是 ( )
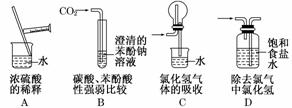
解析:稀释浓硫酸时,将浓硫酸沿着玻璃棒慢慢注入水中,A项正确;CO2通入澄清的苯酚钠溶液,发生反应:CO2+C6H5ONa+H2O―→C6H5OH+NaHCO3,能够证明碳酸的酸性比苯酚强,B项正确;氯化氢极易溶于水,用图示的装置吸收可以防止倒吸,C项正确;用饱和食盐水除去氯气中的氯化氢,气体应从长管进,短管出,D项错误.
答案:D
3.(2010·海淀模拟)实验室从海带灰中提取碘的操作过程中的仪器选用不正确的是 ( )
A.称取3 g左右的干海带--托盘天平
B.灼烧干海带至完全变成灰烬--蒸发皿
C.过滤煮沸后的海带灰和水的混合物--漏斗
D.用四氯化碳从氧化后的海带灰浸取液中提取碘--分液漏斗
解析:托盘天平能精确到0.1 g,可以用托盘天平称取3 g左右的干海带,A对;灼烧干海带至完全变成灰烬,应选择坩埚,B错;过滤实验用到漏斗等仪器,C对;分液操作用到分液漏斗,D对.
答案:B
2.(2010·南昌模拟)下列有关实验操作的说法一定正确的是( )
A.用25 mL碱式滴定管量取20.00 mL高锰酸钾溶液
B.蒸馏时,蒸馏烧瓶内液体体积不能超过容积2/3,液体也不能蒸干
C.用苯萃取溴水中的溴,分液时有机层从分液漏斗下端放出
D.使用pH试纸都必须用蒸馏水润湿
解析:量取20.00 mL KMnO4溶液应用酸式滴定管,A错误;用苯萃取溴时,由于苯的密度小于水,故有机层在上层,分液时,应从上口倒出,C错误;用pH试纸测定溶液pH时不能用蒸馏水润湿,D错误.
答案:B
[基础等级评价]
1.(2010·山东高考)下列与实验相关的叙述正确的是( )
A.稀释浓硫酸时,应将蒸馏水 沿玻璃棒缓慢注入浓硫酸中
沿玻璃棒缓慢注入浓硫酸中
B.配制溶液时,若加水超过容量瓶刻度,应用胶头滴管将多余溶液吸出
C.酸碱滴定时,若加入待测液前用待测液润洗锥形瓶,将导致测定结果偏高
D.检验某溶液是否含有SO时,应取少量该溶液,依次加入BaCl2溶液和稀盐酸
解析:稀释浓硫酸时,应将浓硫酸沿玻璃棒缓慢注入蒸馏水中,A选项错误;若加水超过容量瓶的刻度,则应该重新配制,若用胶头滴管吸出多余溶液,则溶质的量减少,浓度偏低,B选项错误;若用待测液润洗锥形瓶,则待测液中溶质的量增加,消耗的标准液体 积偏大,导致结果偏高,C选项正确;检验某溶液中是否含有SO,应先加入稀盐酸,若没有现象,则排除了Ag+的干扰,然后加入BaCl2溶液,出现白色沉淀,则说明原溶液中含有SO,D选项错误.
积偏大,导致结果偏高,C选项正确;检验某溶液中是否含有SO,应先加入稀盐酸,若没有现象,则排除了Ag+的干扰,然后加入BaCl2溶液,出现白色沉淀,则说明原溶液中含有SO,D选项错误.
答案:C
22.(10分)某研究性学习小组在网上收集到如下信息:Fe(NO 3)3溶液可以蚀刻银,制作美丽的银饰.他们对蚀刻银的原因进行了如下探究:
3)3溶液可以蚀刻银,制作美丽的银饰.他们对蚀刻银的原因进行了如下探究:
[实验]
制备银镜,并与Fe(NO3)3溶液反应,发现银镜溶解.
[提出假设]
假设1:Fe3+具有氧化性,能氧化Ag.
假设2:Fe(NO3)3溶液显酸性,在此酸性条件下NO能氧化Ag.
[设计实验方案,验证假设]
(1)甲同学从上述实验的生成物中检验出Fe2+,验证了假设1成立.请写出Fe3+氧化Ag的离子方程式:_____________________________________________________________
________________________________________________________________________.
(2)乙同学设计实验验证假设2,请帮他完成下表中内容(提示:NO在不同条件下的还原产物较复杂,有时难以观察到气体产生).
|
实验步骤(不要求写具体操作过程) |
预期现象和结论 |
|
① ② …… |
若银镜消失,假设2成立. 若银镜不消失,假设2不成立. |
[思考与交流]
(3)甲同学验证了假设1成立,若乙同学验证了假设2也成立,则丙同学由此得出结论:Fe(NO3)3溶液中的Fe3+和NO都氧化了Ag.
你是否同意丙同学的结论,并简述理由:_______________________________________
________________________________________________________________________.
解析:(2)Fe3+氧化Ag生成Fe2+和Ag+;(3)可用Fe(NO3)3溶液和稀硝酸做对比实验进行验证;(4)丙同学没有检验NO的还原产物,故不能得出题述结论.
答案:(1)Ag+Fe3+===Ag++Fe2+
(2)
|
实验步骤(不要求写具体操作过程) |
预期现象和结论 |
|
①
测定上述实验用的Fe(NO3)3溶液的pH ②配制相同pH的稀硝酸溶液,将此溶液加入有银镜的试管内 |
|
(3)不同意.甲同学检验出了Fe2+,可确定Fe3+一定氧化了Ag;乙同学虽然验证了此条件下NO能氧化Ag,但在硝酸铁溶液氧化Ag时,由于没有检验NO的还原产物,因此不能确定NO是否氧化了Ag(答案合理均可).
0.12 g 0.1×12×10-3 mol
(4)实验结果偏低,意味KMnO4溶液体积偏小.A项,导致所用KMnO4溶液体积偏大;B项,导致所用KMnO4溶液体积偏小;C项,导致所读KMnO4溶液体积偏小;D项, 导致所用KMnO4溶液体积偏大.
导致所用KMnO4溶液体积偏大.
答案:(1)C (2)无 浅紫红 (3)120 (4)BC
21.(8分)(2010·西城模拟)某课外兴趣小组测定某品牌牛奶中钙的含量,方法如下:取100 mL牛奶,加入足量的草酸铵[(NH4)2C2O4]溶液,使牛奶中的钙转化成难溶的CaC2O4沉淀;过滤,用适量的蒸馏水洗涤沉淀表面吸附的少量(NH4)2C2O4、蛋白质等杂质;将沉淀转移至锥形瓶中,加足量的稀硫酸溶液溶解CaC2O4;然后以0.10 mol·L-1的KMnO4溶液滴定生成的H2C2O4溶液,共消耗12.00 mL KMnO4溶液.发生的反应为:
5H2C2O4+2KMnO4+3H2SO4===5CO2↑+2MnSO4+K2SO4+8H2O
(1)若滴定管的规格为25 mL,滴定前滴定管中液面的读数为5.20 mL,则滴定管中液体的体积为________(填代号).
A.5.20 mL B.19.80 mL
C.大于19.80 mL D.小于19.80 mL
(2)本实验不需要外加指示剂,到达滴定终点时溶液的颜色由________色变为________色.
(3)该牛奶中钙的含量为________ mg/100 mL.
(4)下列操作会使实验结果偏低的是________(填代号).
A.滴定管未用KMnO4溶液润洗就直接盛装KMnO4溶液
B.向锥形瓶转移沉淀时,损失部分沉淀
C.开始时平视读数,滴定完成时俯视读数
D.CaC2O4的表面没有洗涤干净,吸附少量C2O等杂质
解析:(1)滴定管下端没有标定刻度,所以滴定管中液体的体积大于19.8 mL.
(2)Ca2+―→(NH4)2C2O4―→CaC2O4―→H2C2O4―→KMnO4
40 g mol
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com