
题目列表(包括答案和解析)
10.(2010·北京市目标检测)已知Ca(OH)2的溶解度随温度的升高而降低。将40℃的饱和澄清石灰水冷却至10℃,或保持40℃向其中加入少量CaO,两种情况下均保持不变的是( )
A.溶液中Ca2+的数目
B.溶剂的质量
C.溶液中溶质的物质的量浓度
D.溶质的质量
解析:将40℃的饱和澄清石灰水冷却至10℃时,此时溶液是不饱和溶液,溶液中溶质质量、溶剂质量均不变,所以溶液中Ca(OH)2的物质的量浓度不变。保持40℃向其中加入少量CaO,CaO与H2O反应导致溶剂质量减少,有部分Ca(OH)2晶体析出,但溶液仍是40℃时的饱和溶液,所以Ca(OH)2的物质的量浓度不变,综合上述知选项C正确。
答案:C
9.(2010·石家庄质检(一))下列各组中两种气体所含的原子数一定相等的是( )
A.质量相等、密度不等的N2和CO
B.温度相同、体积相同的O2和N2
C.体积相等、密度相等的CO和C2H4
D.压强相同、体积相同的N2和O2
解析:A项,氮气和一氧化碳的摩尔质量相等,质量相等时物质的量相等,故原子数一定相等;B项,压强不一定相等,则两气体的物质的量不一定相等;C项,体积和密度相等,则两气体的质量相等,由于摩尔质量相等,则两者的物质的量相等,则原子数之比为1:3;D项,温度不一定相同,则原子数不一定相等。
答案:A
8.(2010·武汉市武昌区调研)设NA为阿伏加德罗常数,下列叙述中正确的是( )
①106 g Na2CO3晶体中的离子总数大于3 NA
②标准状况下,16 g O3和O2混合气体中含有的氧原子数为NA
③将0.1 mol NaCl全部溶于乙醇中制成胶体,其中含有的胶体粒子数目为0.1 NA
④1 mol N2和3 mol H2在一定条件下的密闭容器中充分反应,容器内的分子数大于2 NA
A.①② B.②④
C.①③ D.③④
解析:106 g碳酸钠晶体中的离子总数为3 NA,故①错误;由于胶体粒子是多个微粒的集合体,故③中所含的胶体粒子数目小于0.1 NA,错误;④中由于1 mol N2和3 mol H2发生可逆反应,反应不能进行完全,故反应后气体分子数要大于2 NA,④正确。
答案:B
7.(2010·襄樊市调研)用NA表示阿伏加德罗常数的值。下列叙述正确的是( )
A.标准状况下的33.6 mL氯气通入足量水中,转移电子数为1.5×10-3 NA
B.标准状况下,22.4 L四氯化碳中共价键数目为4 NA
C.1L浓度为1 mol·L-1的Na2CO3溶液中含有3 NA个离子
D.合成氨反应达到平衡时,每形成NA个N≡N键的同时,就有6 NA个N-H键形成
解析:反应Cl2+H2O===HCl+HClO为可逆反应,不可能进行完全,因此33.6 mL氯气通入足量水中,转移电子数小于1.5×10-3 NA,A错;标准状况下四氯化碳为液体,不能运用气体摩尔体积计算其物质的量,B错;Na2CO3溶液中由于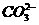 的水解反应:
的水解反应: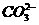 +H2O===HCO-3+OH-,离子数目增多,因此1 L浓度为1 mol/L的该溶液中离子数目大于3NA,C错;根据N2+3H2===2NH3,反应达平衡时,每生成1 mol N2分子(形成1 mol N≡N键)的同时生成2 mol NH3分子(形成6 mol N-H键),D对。
+H2O===HCO-3+OH-,离子数目增多,因此1 L浓度为1 mol/L的该溶液中离子数目大于3NA,C错;根据N2+3H2===2NH3,反应达平衡时,每生成1 mol N2分子(形成1 mol N≡N键)的同时生成2 mol NH3分子(形成6 mol N-H键),D对。
答案:D
6.(2010·江西省高三联考)在200 mL某硫酸盐溶液中,含有1.5 NA个硫酸根离子(NA表示阿伏加德罗常数的值),同时含有NA个金属离子。则该硫酸盐的物质的量浓度为( )
A.1 mol·L-1 B.2.5 mol·L-1
C.5 mol·L-1 D.2 mol·L-1
解析:由硫酸盐溶液中含有1.5 NA个硫酸根离子,同时含有NA个金属离子,可知金属离子与硫酸根离子物质的量之比为2:3,故其化学式可表示为:M2(SO4)3,所以其物质的量浓度为0.5 mol/0.2 L=2.5 mol·L-1。
答案:B
5.(2010·江西省重点中学第二次联考)在4℃时向100 mL水中溶解了22.4 L HCl气体(标准状况下测得)后形成的溶液。下列说法中正确的是( )
A.该溶液物质的量浓度为10 mol/L
B.所得溶液的体积为22.5 L
C.根据题干数据,该溶液物质的量浓度无法求得
D.该溶液中溶质的质量分数因溶液的密度未知而无法求得
解析:该溶液的体积应该大于100 mL,溶液的质量为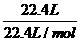 ×36.5 g/mol+100 mL×1 g/mL=136.5 g,由于没有提供溶液的密度,无法计算出溶液的体积,因此该溶液的物质的量浓度无法计算,A错、B错、C对;溶质的质量分数为
×36.5 g/mol+100 mL×1 g/mL=136.5 g,由于没有提供溶液的密度,无法计算出溶液的体积,因此该溶液的物质的量浓度无法计算,A错、B错、C对;溶质的质量分数为 ×100%=26.7%,D错。
×100%=26.7%,D错。
答案:C
4.(2010·江西省高三联考)如图所示,两个连通容器用活塞分开,左右两室(体积相同)各充入一定量NO和O2,且恰好使两容器内气体密度相同。打开活塞,使NO与O2充分反应。下列判断正确的是(不考虑NO2转化为N2O4)( )
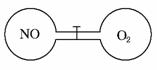
A.开始时左右两室分子数相同
B.反应前后NO室压强相同
C.最终容器内密度与原来相同
D.最终容器内无O2存在
解析:由左右两室体积相同,两容器内气体密度相同可知,两容器中气体的质量一定相等,而NO和O2的摩尔质量不相等,故其物质的量不相等,开始时左右两室分子数不相同,故A错误。由于反应后NO室的气体物质的量要减小,故压强要减小,B错误。由于NO与O2反应,O2过量,故最终容器内有O2存在,D错误。
答案:C
3.(2010·武汉市武昌区调研)设NA为阿伏加德罗常数,下列说法正确的是( )
A.电解精炼铜过程中,电路中每通过NA个电子,阳极溶解铜32 g
B.1 L 2 mol/L的NH4Cl溶液中含NH+4数目为2 NA
C.5.6 g铁粉与硝酸反应失去的电子数一定为0.3 NA
D.1 mol C20H42的分子中含有的共价键数目为61 NA
解析:电解精炼铜时,粗铜作阳极,由于粗铜中含有杂质Fe、Ni等,电路中每通过NA个电子,阳极溶解铜小于32 g,A错;1 L
2 mol/L的NH4Cl溶液中NH+4会发生水解,故其数目小于2 NA,B错;铁粉与硝酸反应时,由于硝酸用量的不同可能生成Fe2+(少量硝酸)或Fe3+(过量硝酸),因此5.6 g铁粉与硝酸反应时失去的电子数为0.2 NA~0.3 NA,C错;1 mol C20H42中含有共价键数目为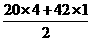 ×NA=61 NA,D对。
×NA=61 NA,D对。
答案:D
2.(2010·南昌市调研)设NA为阿伏加德罗常数,下列说法正确的是( )
A.1 mol氧单质一定含有2 NA个氧原子
B.含4 mol Si-O键的石英晶体中含氧原子数为4 NA
C.6.8 g液态 KHSO4中含有0.05 NA个阳离子
D.1 mol H3O+中含质子数为10 NA
解析:A选项,氧单质指代不明,可能是O2或O3;B选项,1 mol SiO2含有4 mol Si-O键,故含有4 mol Si-O键的石英晶体中含有2 mol O;D选项,1 mol H3O+含有的质子为11 mol。
答案:C
1.(2010·赣州市质检)在化学学科中经常使用下列物理量,其中跟阿伏加德罗常数(NA)无关的组合是( )
①相对原子质量;②摩尔质量(g/mol);③原子半径;④中和热(kJ/mol);⑤物质的量;⑥化学反应速率[mol/(L·s)];⑦气体摩尔体积(L/mol);⑧溶解度;⑨燃烧热(kJ/mol);⑩溶质的质量分数
A.①③⑧⑩ B.②④⑤⑥⑦⑨
C.①②③④⑤ D.⑥⑦⑧⑨⑩
解析:根据物理量的单位,可以判断其与阿伏加德罗常数是否有关,相对原子质量、溶质的质量分数为具体数值,原子半径的单位为nm,溶解度的单位为g,这些物理量与阿伏加德罗常数均无关。
答案:A
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com