
题目列表(包括答案和解析)
7.(2010·郑州市质量预测)下列各组溶液,用括号内的试剂及物质间相互反应不能鉴别的一组是( )
A.Ba(OH)2、KSCN、NaCl、Mg(NO3)2 (FeCl3溶液)
B.NaNO3、NaHCO3、(NH4)2SO3、Na2SiO3 (H2SO4溶液)
C.NH4Br、K2CO3、NaI、CaCl2 (AgNO3溶液)
D.(NH4)2SO4、MgSO4、CuSO4、AlCl3 (KOH溶液)
解析:C项中CaCl2和K2CO3与AgNO3溶液间不能相互鉴别。
答案:C
6.(2010·河南省联考)在中学化学实验中可用来分离或提纯物质的方法很多,如蒸馏、过滤、结晶、渗析、盐析等,分离或提纯下列各组混合物所选用方法最合适的是( )
A.除去Fe(OH)3胶体中混有的Cl---过滤、洗涤、干燥
B. 除去O2中的N2--通过灼热的Cu网
C. 分离NaNO3和BaSO4的混合物--溶解、过滤
D. 从皂化反应后的混合物中分离出高级脂肪酸盐--加入NaCl、渗析
解析:NaNO3溶解于水,BaSO4不溶于水,根据这一性质,采用溶解、过滤等方法可将NaNO3和BaSO4混合物分离。
答案:C
5.(2010·贵州省模拟)用MnO2、NaCl、KClO3、C2H5OH、HCOOH、浓H2SO4等原料不能制得下列气体:①Cl2 ②H2S ③HCl ④C2H4 ⑤CO ⑥C2H2 ⑦O2中的( )
A.①②⑥ B.②⑥
C.②⑤⑦ D.①③④
解析:氯气可由二氧化锰、氯化钠、浓硫酸反应制取;硫化氢气体不能制取,因为没有硫化物;氯化氢气体可由浓硫酸和氯化钠固体加热制取;乙烯气体可由浓硫酸与酒精加热至170℃制取;一氧化碳气体可由甲酸与浓硫酸加热反应制取;乙炔不能制取,因为没有电石;氧气可由氯酸钾与二氧化锰固体混合加热而得到。
答案:B
4.(2010·云南省摸底考试)将氯化铁饱和溶液逐滴加入沸水中,可制得氢氧化铁胶体。为了除去其中所含的盐酸,得到较纯净的胶体,应采取的措施是( )
A.加入NaOH溶液进行中和
B.加入AgNO3溶液反应后过滤
C.插入石墨电极,通入直流电进行电泳后再过滤
D.装入半透膜中并扎紧袋口,将其全部浸入蒸馏水中,并每隔一段时间,更换一次蒸馏水
解析:除去胶体中杂质离子的方法是渗析法,D对。
答案:D
3.(2010·四川省攀枝花市检测)只用一种试剂即可区别NaBr、NaI、NaOH、Na2CO3、NaSCN、H2S、AgNO3、C6H5OH八种无色溶液,这种试剂为( )
A.硫酸 B.氨水
C.FeCl3溶液 D.盐酸
解析:在八种溶液中分别加入适量氯化铁溶液,有关现象如下:
|
NaBr |
NaI |
NaOH |
Na2CO3 |
NaSCN |
H2S |
AgNO3 |
C6H5OH |
|
无明显现象 |
溶液变黄色 |
红褐色沉淀 |
产生气体和红褐色沉淀 |
溶液变血红色 |
浅黄色沉淀 |
白色沉淀 |
溶液变紫色 |
答案:C
2.(2010·石家庄质检(一))常温下,下列各组物质不能用一种试剂通过化学反应区别的是( )
A.MnO2 CuO FeO
B.(NH4)2SO4 K2SO4 NH4Cl
C.Na2CO3 NaHCO3 K2CO3
D.AgNO3 KNO3 Na2CO3
解析:A项,可以用盐酸进行区分;B项,可以用Ba(OH)2溶液进行区分;C项,不能用一种试剂进行区分;D项,可以用盐酸进行区分。
答案:C
1.(2010·北京市海淀区期末)下列获取物质的方法,不正确的是( )
A.用电石和饱和食盐水制取乙炔
B.通过石油分馏得到甲烷、乙烯和苯
C.用碳酸钠和氢氧化钙反应制氢氧化钠
D.将氯气通入氢氧化钠溶液得到漂白液
解析:电石和水反应生成氢氧化钙和乙炔,用饱和食盐水是为了减缓反应速率,A对;要获得甲烷、乙烯等,必须通过石油的裂解,B错;碳酸钠和氢氧化钙发生复分解反应:Na2CO3+Ca(OH)2===2NaOH+CaCO3↓,C对;氯气通入氢氧化钠溶液发生反应:Cl2+2NaOH===NaCl+NaClO+H2O,D对。
答案:B
(2)不能 若KMnO4溶液的紫红色褪去或变浅,则说明产物中含+2价铁元素;若KMnO4溶液不褪色或不变浅,则说明产物中不含+2价铁元素 另取少量溶液,滴加KSCN溶液
9.(2010·上海卷)CaCO3广泛存在于自然界,是一种重要的化工原料。大理石主要成分为CaCO3,另外有少量的含硫化合物。实验室用大理石和稀盐酸反应制备CO2气体。下列装置可用于CO2气体的提纯和干燥。
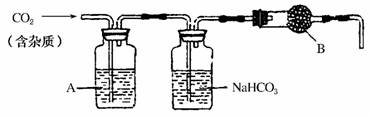
完成下列填空:
(1)用浓盐酸配制1:1(体积比)的稀盐酸(约6 mol·L-1),应选用的仪器是________。
a.烧杯 b.玻璃棒 c.量筒 d.容量瓶
(2)上述装置中,A是________,NaHCO3溶液可以吸收________。
(3)上述装置中,B物质是________。用这个实验得到的气体测定CO2的分子量,如果B物质失效,测定结果________(填“偏高”、“偏低”或“不受影响”)。
(4)一次性饭盒中石蜡(高级烷烃)和CaCO3在食物中的溶出量是评价饭盒质量的指标之一,测定溶出量的主要实验步骤设计如下:
剪碎、称重―→浸泡溶解―→过滤―→残渣烘干―→冷却、称重―→恒重
为了将石蜡和碳酸钙溶出,应选用的试剂是________。
a.氯化钠溶液 b.稀醋酸 c.稀硫酸 d.正己烷
(5)在溶出量测定实验中,为了获得石蜡和碳酸钙的最大溶出量,应先溶出________,后溶出________。
(6)上述测定实验中,连续________________,说明样品已经恒重。
解析:(1)考查等体积比浓度的溶液配制,用量筒量取等体积水与浓盐酸,倒入烧杯,搅拌混合即可。
(2)由于制备得到的CO2中含H2S以及反应挥发出的HCl,因此可通过CuSO4溶液除去H2S,通过饱和NaHCO3溶液除去HCl。
(3)固体B应为无水CaCl2,可除去CO2中的H2O(g)。如果CaCl2失效,则气体为CO2与H2O(g)的混合气体,其平均分子量小于CO2的分子量,因此测定结果偏低。
(4)要溶于CaCO3应选用稀醋酸,不能用稀H2SO4,因为H2SO4与CaCO3反应生成的CaSO4,微溶于水。正己烷用于溶解石蜡。
(5)先用正己烷溶解石蜡,才能使其中的CaCO3与醋酸充分接触发生反应,使二者达到最大溶出量。
(6)两次称量的质量差不超过0.001 g,说明已经恒重。
答案:(1)abc
(2)CuSO4溶液或酸性KMnO4溶液 HCl气体或酸性气体
(3)无水CaCl2 偏低 (4)bd (5)石蜡 CaCO3
(6)两次称量的结果相差不超过(或小于)0.001 g
(2)先把导气管移出水面,然后熄灭酒精灯火焰
(3)O2
(2)步骤1:Fe2+在溶液中为浅绿色,Fe3+在溶液中为棕黄色,而该溶液呈蓝绿色,因此不能确定产物中铁元素的价态;步骤2:酸性KMnO4溶液具有氧化性,能够氧化Fe2+,因此若KMnO4溶液的紫红色褪去或变浅说明产物中含+2价的铁元素,否则不含;步骤3:为检验溶液中是否含有+3价的铁元素,现象为溶液变为红色,因此用的试剂是KSCN溶液。
答案:(一)(1)生成等物质的量的硝酸铜,消耗硝酸原料多 产生污染物NO
(2)坩埚 蒸发浓缩 冷却结晶
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com