
题目列表(包括答案和解析)

[基础等级评价]
1.(2010·东城模拟)月球含有丰富的He,下列关于He的说法不正 确的是( )
确的是( )
A.是一种核素 B .原子核内有1个中子
.原子核内有1个中子
C.与He互为同位素 D.比He少一个电子
解析:He和He的核外电子数相等,都为2.
答案:D
2.(4)12
(5)25 g H2O
22.(10分)(2010·长安一中、高新一中、交大附中、师大附中、西安中学第二次模拟考试)A、B、C三种强电解质,它们在水中电离出的离子如下表所示:
|
阳离子 |
Ag+ Na+ |
 阴离子 阴离子 |
NO SO Cl- |
下图所示装置中,甲、乙、丙三个烧杯依次分别盛放足量的A、 B、 C三种溶液,电极均为石墨电极.接通电源,经过一段时间后,测得乙中C电极质量增加了27克.常温下各烧杯中溶液的pH与电解时间t的关系图如下.据此回答下列问题:
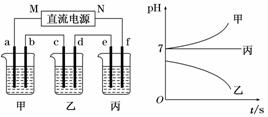
(1)M为电源的________极(填写“正”或“负”),甲________(填写化学式).
(2)计算电极f上生成的气体在标准状况下的体积________________________________.
(3)写出乙烧杯的电解池反应_________________________________________________.
(4)若电解后甲溶液的体积为25 L,则该溶液的pH为________________________.
(5)要使丙恢复到原来的状态,应加入________ g ________.(填写化学式)
解析:接通电源,经过一段时间后,测得乙中C电极质量增加了27克,说明乙中溶质是硝酸银,Ag++e- =Ag,得到27克Ag,电路中通过的电子是0.25 mol.
结合图可知甲的pH增大是氯化钠,丙的pH不变是硫酸钠.电极f上生成的气体是O2, 0.25 mol 电子可电解水2.25 g,产生0.0625 mol O2.
答案:(1)负 NaCl (2)1.4 L (3) 4AgNO3+2H2O通电4Ag+O2↑+4HNO3
21.(8分)某同学利用下图所示方法制取一定浓度的双氧水,并且测定其质量分数.
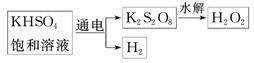
请回答下列问题:
(1)电解KHSO4饱和溶液时,阳极的电极反应式为______________________________
________________________________________________________________________.
(2)测定所得H2O2溶液的质量分数:
①移取10.00 mL H2O2溶液(密度为1.00 g/mL)至250 mL ________(填仪器名称)中,加水稀释至刻度,摇匀.移取稀释后的H2O2溶液25.00 mL至锥形瓶中,加入稀硫酸酸化,用蒸馏水稀释,作被测试样.
②用0.0100 mol/L高锰酸钾标准溶液滴定被测试样,其反应的离子方程式如下,请将相关物质的化学计量数填写在方框里.
H++MnO+H2O2--Mn2++O2↑+H2O
③滴定时,高锰酸钾溶液应装在________.滴定到达终点的现象是_______________
________________________________________________________________________.
④上述操作②中,滴入第一滴KMnO4溶液,溶液紫红色消失很慢,随着滴定过程中Mn2+的增多,溶液紫红色消失速率迅速加快.则Mn2+作用的是________________________.
⑤若滴定前俯视读数,滴定后仰视读数,则测定结果________(填“偏高”、“偏低”或“不变”).
⑥用同样方法滴定,三次消耗KMnO4溶液的体积分别为20.00 mL、19.98 mL、20.02 mL.则所得H2O2溶液的质量分数是_________________________________________________.
解析:本题利用KMnO4氧化双氧水的反应原理进行滴定来测定双氧水的质量分数,KMnO4溶液具有强氧化性,要用酸式滴定管来盛装,双氧水作为待测液要放在锥形瓶中,由于KM nO4溶
nO4溶 液呈紫红色,刚好完全反应后呈无色,因此不需要滴加指示剂就可以进行终点判断.
液呈紫红色,刚好完全反应后呈无色,因此不需要滴加指示剂就可以进行终点判断.
根据6H++2MnO+5H2O2===2Mn2++5O2↑+8H2O可求得H2O2的物质的量是5×10-4 mol,进一步求得H2O2溶液的质量分数是1.7%.
答案:(1)2SO-2e-===S2O
(2)①容量瓶 ②6 2 5 2 5 8
③酸式滴定管 滴入一滴高锰酸钾溶液,溶液呈浅红色,且30秒内不褪色
④催化剂 ⑤偏高 ⑥1.7%
20.(11分)(2010·长春市第三次调研)300℃时,将2 mol A和 2 mol B两种气体混合于2 L密闭容器中,发生如下反应:3A(g)+B(g)
2 mol B两种气体混合于2 L密闭容器中,发生如下反应:3A(g)+B(g) 2C(g)+2D(g);ΔH=Q,2 min末达到平衡,生成0.8 mol D.
2C(g)+2D(g);ΔH=Q,2 min末达到平衡,生成0.8 mol D.
(1)升高温度C的百分含量增大,则ΔH________0(填“>”或“<”).
(2)在2 min末时,B的平衡浓度为________,D的平均 反应速率为________________________________________________________________________.
反应速率为________________________________________________________________________.
(3)若温度不变,缩小容器容积,则A的转化率______(填“增大”、“减小”或“不变”),原因是_________________________________________________________________.
(4)如果在相同的条件下,上述反应从逆反应方向进行, 开始时若加入C、D各 mol.若使平衡时各物质的物质的量浓度与原平衡相同,则还原该加入B____________ mol.
开始时若加入C、D各 mol.若使平衡时各物质的物质的量浓度与原平衡相同,则还原该加入B____________ mol.
解析:(1)升高温度C的百分含量增大,说明正反应吸热ΔH>0.
(2) 3A(g)+B(g)  2C(g)+2D(g)
2C(g)+2D(g)
起始:1 1 0 0
转化:0.6 0.2 0.4 0.4
平衡:0.4 0.8 0.4 0.4
则B的平衡浓度为0.8 mol/L, D的平均反应速率0.2 mol/(L·min).
(4)该问题是等效平衡问题,对于两边气体系数之和相等的可逆反应,只要在作等效处理后各物质的量的比值相等,就处于相同的平衡状态
3A(g)+B(g)  2C(g)+2D(g)
2C(g)+2D(g)
起始: 1 1 0 0
起始: 0 x
将C、D全部折算为A、B.
n(A)=1 mol/L,n(B)= mol/L,
所以x= mol/L,即加入B mol.
答案:(1)>
(2)0.8 mol·L-1 0.2 mol·L-1·min-1
(3)不变 反应前后气体体积不变,压强对平衡无影响
(4)
19.(8分)常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
|
实验编号 |
HA物质的量浓度(mol/L) |
NaOH物质的量浓度(mol/L) |
混合溶液的pH |
|
甲 |
0.2 |
0.2 |
pH=a |
|
乙 |
c1 |
0.2 |
pH=7 |
|
丙 |
0.1 |
0.1 |
pH>7 |
|
丁 |
0.1 |
0.1 |
pH=9 |
请回答:
(1)不考虑其他组的实验结果,单从甲组情况分析,如何用a(混合溶液的pH)来说明HA是强酸还是弱酸:
________________________________________________________________________
__________ ________________________________
________________________________ ______________________________.
______________________________.
(2)不考虑其他组的实验结果,单从乙组情况分析,c1________等于0.2 mol·L-1(“一定”或“不一定”).混合溶液中离子浓度c(A-)与c(Na+)的大小关系是________(填字母序号).
A.前者大 B.后者大
C.二者相等 D.无法判断
(3)从丙组实验结果分析,HA是________酸(“强”或“弱”),该混合溶液中离子浓度由大到小的顺序是____________________________________________.
(4)丁组实验所得混合溶液中由水电离出的c(OH-)=________ mol·L-1.写出该混合溶液中c(Na+)-c(A-)=________ mol·L-1的精确结果(不能做近似计算,回答准确值,结果不一定要化简).
解析:(1)甲组中HA和NaOH恰好完全反应,根据NaA是否发生水解来判断HA是否为弱酸.
(2)乙组中,若HA为强酸,则c1=0.2 mol·L-1,若HA为弱酸,则c1>0.2 mol·L-1.由pH=7,c(H+)=c(OH-),根据溶液电荷守恒知c(A-)=c(Na+).
(3)丙组HA与NaOH恰好完全反应,反应后NaA溶液的pH>7,则说明NaA为强碱弱酸盐,HA为弱酸.
(4)丁组中HA与NaOH恰好完全反应,NaA溶液的pH=9,A-水解促进水的电离,OH-来自于水的电离,则c(H+)水=c(OH-)水=1×10-5 mol·L-1,由电荷守恒知,c(Na+)+c(H+)=c(A-)+c(OH-),则c(Na+)-c(A-)=c(OH-)-c(H+)=1.0×10-5 mol·L-1-1.0×10-9 mol·L-1.
答案:(1)a=7时,HA是强酸,a>7时,HA为弱酸
(2)不一定 C
(3)弱 c(Na+)>c(A-)>c(OH-)>c(H+)
(4)1.0×10-5 10-5-10-9
18.(8分)(2010·长沙一中、雅礼中学高三5月质量检测)下面是元素周期表的一部分,表中所列字母分别代表某一化学元素.
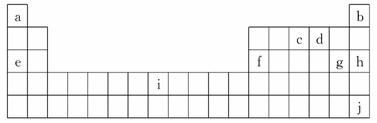
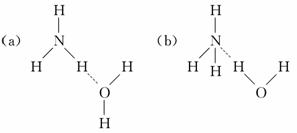
(1)NH3·H2O的电离方程式NH3·H2O NH+OH-,试判断NH3溶于水后,形成的NH3·H2O的合理结构________(填字母代号).
NH+OH-,试判断NH3溶于水后,形成的NH3·H2O的合理结构________(填字母代号).
(2)上表中的c原子间也可形成链状结构,假设c原子间只以单键形式连接,并形成与直链烷烃类似的氢化物,则该系列氢化物的通式为_________________________________.
(3)利用稀有气体化合物,人们实现了许多制备实验上的突破.如用j的+6价氧化物在碱性条件下与NaBrO3反应生成NaBrO4,同时生成j的单质.写出上述反应的方程式________________________________________________________________________.
(4)若已知原子结构规律不变,则第166号新元素在元素周期表中位置:________________________________________________________________________.
解析:(1)a结构电离不出NH和OH-.
(2)由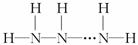 可以看出氢化物的通式为NnHn+2.
可以看出氢化物的通式为NnHn+2.
(4)第七周期排满,最后一种元素的原子序数是118,第八周期排满,最后一种元素的原子序数是168,则第166号新元素在元素周期表中位置第八周期ⅥA族.
答案:(1)b (2)NnHn+2
(3)3NaBrO3+XeO3===3NaBrO4+Xe
(4)第八周期ⅥA族
17.(8分)A、B、C、D、E五种短周期元素,核电荷数依次增加,其中A与D同族,C与E同族;A的一种原子内无中子,B原子最外层电子数是内层电子数的2倍,一个C2-离子含10个电子.
(1)甲是由A、B、C三种元素组成的相对分子质量最小的物质,且可以发生银镜反应.甲的一种用途是________;由甲中的两种元素组成,且与甲等电子的物质为乙,乙与C的单质在KOH溶液中形成燃料电池(惰性电极)的正极反应式为________.
(2)D 与C形成的一种化合物具有强氧化性,这种化合物中阴离子与阳离子个数比为________;
(3)均由A、C、D、E四种元素组成的两种物质丙和丁在溶液中反应离子方程式是:______________________ __________________________________________________.
__________________________________________________.
解析:由题中信息可知,A是H、B是C、C是O、 D是Na、E是S,甲是甲醛、乙是乙烯、丙丁分别是硫酸氢钠和亚硫酸氢钠.
D是Na、E是S,甲是甲醛、乙是乙烯、丙丁分别是硫酸氢钠和亚硫酸氢钠.
答案:(1)消毒或杀菌或防腐 O2+2H2O+4e-===4OH-
(2)1∶2
(3)H++HSO===H2O+SO2 ↑
16.磷酸燃料电池是目前较为成熟的燃料电池,其基本组成和反应原理如下.
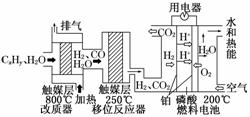
下列说法不正确的是( )
A.在改质器中主要发生的反应为CxHy+xH2O800℃xCO+(x+y/2)H2
B.移位反应器中CO(g)+H2O(g)  CO2(g)+H2(g) ΔH>0.温度越高,CO转化速率越大
CO2(g)+H2(g) ΔH>0.温度越高,CO转化速率越大
C.负极排出的气体主要是CO2
D.该电池正极的电极反应为O2+4H++4e-===2H2O
解析:由图可知,CxHy和H2O通过改质器后,生成CO和H2, 所以A正确.触媒在多高温度下活性最强,是实验得结果,高于或低于合适温度,催化活性都会降低或消失,B错.由图看出C、D两项正确.
答案:B
15.某温度下,相同pH值的盐酸和醋酸溶液分别加水稀释,pH值随溶液体积变化的曲线如图所示.据图判断正确的是( )
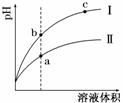
A.Ⅱ为盐酸稀释时的pH值变化曲线
B.b点溶液的导电性比c点溶液的导电性强
C.a点KW的数值比c点KW的数值大
D.b点酸的总浓度大于a点酸的总浓度
解析:两种酸起始pH相同,即c(H+)相同,说明:起始时,c(弱酸溶质)远大于c(强酸溶质);弱酸原来的c(H+)已等于强酸的c(H+),由于稀释使弱酸的电离度增大,所以在稀释的整个过程中,弱酸的c(H+)都大于强酸的c(H+),即pH是:弱酸<强酸,所以曲线Ⅱ是醋酸、Ⅰ是盐酸,A项错.由于在整个稀释过程中,醋酸的浓度始终大于盐酸的,所以D项错.溶液导电性强弱取决于离子浓度大小,对于酸而言,其pH越大,c(H+)越小,离子浓度越小,导电能力越弱,所以B项正确.KW的大小只取决于温度,与溶液的浓度无关,C项错.
答案:B
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com