
题目列表(包括答案和解析)
3.下列物质溶于水时会破坏水的电离平衡,且属于电解质的是( )
A.氯气 B.氨气
C.硫酸钠 D.次氯酸钠
解析:只有C、D项的物质是电解质,硫酸钠不会破坏水的电离平衡,次氯酸钠能促进水的电离。
答案:D
2.下列有关化学用语正确的是( )
A.苯酚钠的结构简式: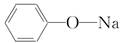
B.NaClO的电子式为:Na+[∶····∶····∶]-
C.NaCl晶胞结构示意图: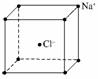
D.Cl-的结构示意图: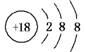
解析:A选项苯酚钠属于离子化合物,苯酚根离子和钠离子之间以离子键结合;C选项为氯化铯的晶胞结构示意图;D选项Cl原子核内有17个质子,带17个单位的正电荷。
答案:B
1.人类始祖“阿尔迪”被世界著名杂志《时代》评为2009年世界十大科技发现之首,人类始祖距今已有440万年。碳有三种核素:C是放射性元素,可根据其半衰期测定文物年代,C和C在自然界中稳定存在。下列有关说法正确的是( )
A.C、C、C互为同素异形体
B.等物质的量的C、C、C,中子数之比为12:13:14
C.阿伏加德罗用C做实验测定阿伏加德罗常数
D.m g C含质子数为2m×6.02×1023
解析:C、C、C是一组质子数相同,中子数不同(质量数不同)的原子(也称为核素),互为同位素,同种元素组成不同性质的单质,如金刚石、石墨、C60互为同素异形体,A选项错误;原子中,中子数等于质量数减去质子数,故C、C、C的中子数依次为6、7、8,B选项错误;m g C中所含质子的物质的量为×6 mol= mol,故质子数为×6.02×1023,D选项错误。
答案:C
15.(1)Cl2(g)+P(s)===PCl3(g) ΔH=-306 kJ/mol
(2)PCl5(g)===PCl3(g)+Cl2(g) ΔH=93 kJ/mol 25% 大于
(3)两步反应均为放热反应,降温有利于提高产率,防止产物分解
(4)-399 kJ/mol 等于
(5)PCl5+4H2O===H3PO4+5HCl
14.(1)NO2(g)+CO(g)===CO2(g)+NO(g) ΔH=-234 kJ/mol (2)> (3)30% 大 (4)O2+2H2O+4e-―→4OH-
13.(1)反应物能量 生成物能量 没有影响 降低 因为催化剂改变了反应历程,使活化能E降低
(2)-198
(3)SO2+V2O5===SO3+2VO2 ,4VO2+O2===2V2O5
(4)0.025 0.05
(5)-1 185 kJ/mol
11.A 12.C
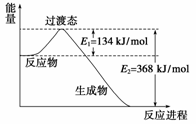
15.(14分)(2008·全国理综Ⅱ,26)红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。反应过程和能量关系如图所示(图中的ΔH表示生成1mol产物的数据)。根据下图回答下列问题:
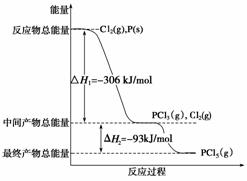
(1)P和Cl2反应生成PCl3的热化学方程式是______________________________________
________________________________________________________________________。
(2)PCl5分解成PCl3和Cl2的热化学方程式是_____________________________________
________________________________________________________________________。
上述分解反应是一个可逆反应。温度T1时,在密闭容器中加入0.80 mol PCl5,反应达平衡时PCl5还剩0.60 mol,其分解率α1等于________;若反应温度由T1升高到T2,平衡时PCl5的分解率为α2,α2________α1(填“大于”、“小于”或“等于)。
(3)工业上制备PCl5通常分两步进行,先将P和Cl2反应生成中间产物PCl3,然后降温,再和Cl2反应生成PCl5。原因是_____________________________________________。
(4)P和Cl2分两步反应生成1 mol PCl5的ΔH3=______,P和Cl2一步反应生成1 mol PCl5的ΔH4____________ΔH3(填“大于”、“小于”或“等于”)。
(5)PCl5与足量水充分反应,最终生成两种酸,其化学方程式是______________________。
答案 1.D 2.D 3.B 4.C 5.C 6.A 7.A 8.D 9.D 10.D
14.(12分) (1)下图是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:__________________________________________________
________________________________________________________________________。
(2)我国实施“嫦娥探月”行动的长征火箭中使用偏二甲肼[(CH3)2N-NH2]作为燃料,其与过氧化氢发生反应放出大量热量C2H8N2(l)+8H2O2(l)===N2(g)+2CO2(g)+12H2O(g) ΔH=-2 500 kJ/mol。如果1 mol偏二甲肼与过氧化氢发生上述反应生成液态水,则反应 中放出的热量Q______2 500 kJ(填“<”、“>”或“=”)。
(3)恒温恒容下,2 mol H2与2 mol N2反应达到平衡时,N2为1.8 mol,H2的转化率为________;若该反应在恒温恒压条件下进行(其他条件相同),反应达平衡时,H2的转化率比上述条件下H2的转化率________(填“大”、“小”或“相等”)。
(4)由甲烷、氧气和KOH溶液组成的新型燃料电池中,正极上发生反应的电极反应式为________________________________________________________________________
________________________________________________________________________。
13. (14分)(2009·宁夏理综,28)2SO2(g)+O2(g)2SO3(g),反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH=-99 kJ/mol。
(14分)(2009·宁夏理综,28)2SO2(g)+O2(g)2SO3(g),反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH=-99 kJ/mol。

请回答下列问题:
(1)图中A、C分别表示__________、______________,E的大小对该反应的反应热有无影响?______________。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低?____________,理由是________________________________________________;
(2)图中ΔH=__________kJ/mol;
(3)V2O5的催化循环机理可能为:V2O5氧化SO2时,自身被还原为四价钒化合物;四价钒化合物再被氧气氧化。写出该催化循环机理的化学方程式_______________________
________________________________________________________________________;
(4)如果反应速率v(SO2)为0.05 mol/(L·min),则v(O2)=________mol/(L·min)、
v(SO3)=________mol/(L·min);
(5)已知单质硫的燃烧热为296 kJ/mol,计算由S(s)生成3 mol SO3(g)的ΔH=_____________________________________________________________(要求计算过程)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com