
题目列表(包括答案和解析)
4.(2010·莆田模拟)实验室可采用多种方法制取氨气.
(1)请从下图中选择最恰当的气体发生装置,将相应字母标号填入下表:
|
方法 |
Ⅰ |
Ⅱ |
…… |
|
试剂 |
仅用浓氨水 |
浓氨水、氢氧化钠固体 |
…… |
|
装置 |
|
|
…… |
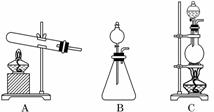
(2)如何检验生成的气体是氨气?______________________________________________.
解析:(1)实验室制取氨气,可以采取加热浓氨水的方法,装置选择C;也可以选用氢氧化钠固体和浓氨水,向NaOH固体中滴加浓氨水,NaOH固体溶解放热,氨气受热挥发,故装置选择B.
(2)检验氨气,可以利用氨气能使湿润的红色石蕊试纸变蓝的性质检验.
答案:(1)C B
(2)把湿润的红色石蕊试纸靠近导管口,试纸变蓝
3.下列实验方案设计正确的是( )
A.分解高锰酸钾制取氧气后,残留在试管内壁上的黑色物质可用稀盐酸洗涤
B.失去标签的AgNO3溶液、稀盐酸、NaOH溶液、AlCl3溶液可选用 (NH4)2CO3溶液作鉴别试剂
(NH4)2CO3溶液作鉴别试剂
C.用铜丝代替铂丝做焰色反应
D.在裂化汽油中加入酸性高锰酸钾,振荡后若紫色褪去即可证明其中含甲苯等苯的同系物
解析:加入(NH4)2CO3溶液时,AgNO3溶液中产生白色沉淀,稀盐酸中产生无色无味气体,NaOH溶液中产生无色有刺激性气味的气体,AlCl3溶液中既有白色沉淀又有无色无味气体产生.高锰酸钾分解后残留二氧化锰,可以用热的浓盐酸洗涤,不能用稀盐酸来清洗.做焰色反应实验应选用铂丝,不能选用铜丝,因为铜丝灼烧时会产生明显的绿色火焰.裂化汽油中含有不饱和烃,能使酸性高锰酸钾溶液褪色.
答案:B
2.某同学想用实验证明高锰酸钾溶液的紫红色是MnO的颜色,而不是K+的颜色,他设计的下列实验步骤中没有意义的是( )
A.将高锰酸钾晶体加热分解,所得固体质量减少
B.观察氯化钾溶液没有颜色,表明溶液中K+无色
C.在氯化钾溶液中加入适量锌粉振荡,静置后未见明显变化,表明锌与K+无反应
D.在高锰酸钾溶液中加入适量锌粉振荡,静置后见紫红色褪去,表明MnO为紫红色
解析:首先高锰酸钾溶液中存在两种离子:K+和MnO,选项B、C表明K+无色且不与锌反应,再由选项D进一步说明MnO能与锌反 应,静置后见紫红色褪去,表明MnO为紫红色.
应,静置后见紫红色褪去,表明MnO为紫红色.
答案:A
1.某化学小组在常温下测定一定质量的某铜铝混合物中铜的质量分数,设计了如下实验方案:
方案Ⅰ:铜铝混合物――――→,\s\up7(足量溶液A充分反应测定生成气体的体积
方案Ⅱ:铜铝混合物――――→,\s\up7(足量溶液B充分反应测定剩余固体的质量
下列有关判断中不正确的是( )
A.溶液A和B均可以是盐酸或NaOH溶液
B.溶液A和B均可以选用稀硝酸
C.若溶液B选用浓硝酸,则测得铜的质量分数偏小
D.实验室方案Ⅱ更便于实施
解析:因铝具有两性,而铜不能与碱、无氧化性酸反应,所以A和B是盐酸或氢氧化钠时,都与铝反应,故A可行;又因测固体质量比测气体体积易进行,故D正确;若A和B都是稀硝酸时则方案Ⅱ无法实施,故B错;若B是浓硝酸则铝钝化,导致剩余固体质量增加,所以测得铜的质量分数偏小,故C正确.
答案:B
14.(15分)(2010·江苏高考)钡盐行业生产中排出大量的钡泥[主要含有BaCO3、BaSiO3、BaSO3、Ba(FeO2)2等].某主要生产BaCl2、BaCO3、BaSO4的化工厂利用钡泥制取Ba(NO3)2,其部分工艺流程如下:
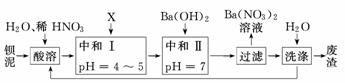
(1)酸溶后溶液的pH=1,Ba(FeO2)2与HNO3反应的化学方程式为________________
________________________________________________________.
(2)酸溶时通常控制反应温度不超过70℃,且不使用浓硝酸,原因是________________、_______________________________________________________________________.
(3)该厂结合本厂实际,选用的X为________(填化学式);中和Ⅰ使溶液中________(填离子符号)的浓度减小(中和Ⅰ引起的溶液体积变化可忽略).
(4)上述流程中洗涤的目的是_________________________________________________.
解析:(1)Ba(FeO2)2与HNO3反应的化学方程式为:Ba(FeO2)2+8HNO3===Ba(NO3)2+2Fe(NO3)3+4H2O.
(2)温度越高反应速率越快,故控制温度不超过70℃是为了防止反应速率过快,且浓硝酸越浓越易分解,温度高既易挥发,也易分解,故不用浓硝酸.
(3)X既要能中和硝酸,又不产生新杂质,故可用BaCO3;中和Ⅰ使溶液中的Fe3+形成Fe(OH)3沉淀、H+浓度减小.
(4)因为钡盐是重金属盐,有毒,故洗涤的目的是减少废渣中可溶性钡盐对环境的污染.
答案:(1)Ba(FeO2)2+8HNO3===Ba(NO3)2+2Fe(NO3)3+4H2O
(2)防止反应速率过快 浓HNO3易挥发、分解(凡合理答案均可)
(3)BaCO3 Fe3+、H+
(4)减少废渣中可溶性钡盐对环境的污染(凡合理答案均可)

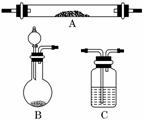
13.(13分)已知Zn跟一定量的浓H2SO4反应生成的气体产物有两种,请从下图中选用所需的仪器组成一套进行该反应并检出气体产物的装置(装置可重复选用,假设每步反应都完全进行,且无需干燥).现提供Zn、浓H2SO4,其他试剂自选(固定仪器用的铁夹、铁架台及加热装置等均略去).将所选的仪器按连接顺序由上至下依次填入下表,并写出该仪器中应加的试剂、作用及现象.(可不填满,也可加行)
|
选用的仪器(填字母) |
加入的试剂 |
作用 |
现象 |
|
|
Zn、浓H2SO4 |
产生两种气体 |
- |
|
|
|
|
|
|
|
|
除SO2 |
- |
|
|
|
|
|

解析:Zn与一定量的浓H2SO4反应生成SO2和H2两种气体,发生装置选择装置B;检验SO2用品红溶液,选择装置C,现象是品红溶 液褪色;除去SO2用NaOH溶液,选择装置C;检验H2用黑色CuO粉末,选择装置A,现象是加热后固体由黑色变为红色.
液褪色;除去SO2用NaOH溶液,选择装置C;检验H2用黑色CuO粉末,选择装置A,现象是加热后固体由黑色变为红色.
答案:
|
选用的仪器(填字母) |
加入的试剂 |
作用 |
现象 |
|
B |
|
|
- |
|
C |
品红溶液 |
检验SO2 |
品红溶液褪色 |
|
C |
NaOH溶液 |
|
- |
|
A |
CuO |
检验H2 |
加热后固体由黑变红 |
12.(11分)(2010·山东高考)聚合硫酸铁又称聚铁,化学式为[Fe2(OH)n(SO4)3-0.5n]m,广泛 用于污水处理.实验室利用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁和绿矾(FeSO4·7H2O),过程如下:
用于污水处理.实验室利用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁和绿矾(FeSO4·7H2O),过程如下:

(1)验证固体W焙烧后产生的气体含有SO2的方法是___________________________.
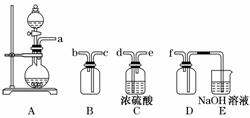
(2)实验室制备、收集干燥的SO2,所需仪器如下.装置A产生SO2,按气流方向连接各仪器接口,顺序为a→______→________→________→________→f.装置D的作用是________,装置E中NaOH溶液的作用是________.
(3)制备绿矾时,向溶液X中加入过量________,充分反应后,经________操作得到溶液Y,再经浓缩、结晶等步骤得到绿矾.
(4)溶液Z的pH影响聚铁中铁的质量分数,用pH试纸测定溶液pH的操作方法为________________________________.若溶液Z的pH偏小,将导致聚铁中铁的质量分数偏________.
解析:(1)检 验SO2气体可选用品红试液、溴水或酸性KMnO4溶液.
验SO2气体可选用品红试液、溴水或酸性KMnO4溶液.
(2)生成的SO2先通过C装置干燥,然后经B装置用排空气法收集,最后连接装置D,显然装置D作安全瓶,防倒吸,而E中NaOH溶液用于吸收尾气.
(3)根据聚铁的化学式可知铁元素的化合价为+3,由此可推知溶液X中主要含Fe3+,因此在制绿矾时,应向溶液X中加入过量的铁屑,经过滤操作即得FeSO4溶液.
(4)若pH太小,酸性太强,则Fe3+不易沉淀生成聚铁,故铁的质量分数偏小.
答案:(1)将气体通入品红溶液,溶液褪色,加热恢复原色(合理即得分)
(2)d→e→c→b 防止倒吸 吸收多余的SO2
(3)铁屑 过滤
过滤
(4)将小片pH试纸放在点滴板(或表面皿)上,用玻璃棒蘸取少量待测液点在试纸上,与标准比色卡对照 低(小)
11.(11分)(2010·唐山模拟)教材中经常利用如图装置进行有关物质的制备和性质实验.
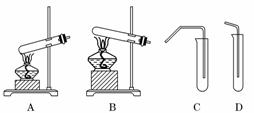
(1)请按要求填充下表空格:
|
实验名称 |
选用的仪器(填字母) |
C或D中所盛试剂(填名称) |
C或D中的现象 |
|
区别固体Na2CO3和NaHCO3 |
BD |
澄清石灰水 |
|
|
铜和浓硫酸反应 |
AC |
|
溶液红色褪去 |
|
制备乙酸乙酯 |
|
饱和碳酸钠溶液 |
上层有透明油状液体产生并有香味 |
(2)针对上述实验下列说法正确的是(填写字母代号)________.
A.Cu和浓硫酸反应时,可在装置C的试管口塞沾有碱液的棉花
B.加热装置C中已吸收Cu和浓硫酸反应生成物后的溶液不能出现红色
C.制备乙酸乙酯时,装置C的导管末端在液面以下
D.装置B可用于制备氨气
解析:(1)碳酸氢钠受热分解产生二氧化碳,二氧化碳使澄清石灰水变浑浊;根据现象“溶液红色褪去”及铜与浓硫酸反应的产物可知加入的试剂为品红溶液;实验室中制备乙酸乙酯的反应物为液体,所以选用装置A作为反应器,用装置C作为乙酸乙酯的接收装置及除杂装置.
(2)铜与浓硫酸反应容易逸出有毒气体二氧化硫,该气体可以溶解在碱液中,所以可以用沾有碱液的棉花吸收,A正确;品红溶液吸收二氧化硫生成不稳定的无色物质,加热可以释放出二氧化硫,品红溶液恢复红色,B错误;为了防止倒吸,制备乙酸乙酯时,装置C的导管不能插入吸收液中,C错误;装置B是加热固体反应物的装置,可以制备氨气,D正确.
答案:(1)
|
|
|
|
|
|
|
|
|
澄清石灰水变浑浊 |
|
|
|
品红溶液 |
|
|
|
AC |
|
|
(2)AD
10.已知在温度低于570℃时,还原铁粉与水蒸气反应的产物是FeO,高于570℃时,生成Fe3O4.老师用如图所示实验装置,完成了还原铁粉与水蒸气反应的演示实验.
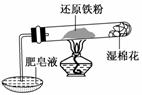
甲同学为探究实验后试管内的固体含有哪些物质,进行了下列实验:
|
实验编号 |
实验操作 |
实验现象 |
|
① |
取少量黑色粉末放入试管中,加入盐酸,微热 |
黑色粉末逐渐溶解,溶液呈浅绿色;有少量气泡产生 |
|
② |
向试管中滴加几滴KSCN溶液,振荡 |
溶液没有出现红色 |
根据上述实验,下列说法不正确的是( )
A.试管内的固体一定含有铁粉
B.试管内的固体一定不含有Fe3O4
C.不能确定试管内的固体是否含有FeO
D.可通过将试管内固体彻底还原,分析其质量减小的方法来确定是否含有Fe3O4
解析:由加入盐酸溶解时有少量气泡产生,说明黑色粉末中含有铁粉,因铁粉能与三价铁离子反应生成二价铁离子,故不能确定黑色粉末中是否含有Fe3O4,B项错误.
答案:B
9.下图表示从固体混合物中分离X的两种方案,请根据方案1和方案2指出下列说法合理的是( )
方案1
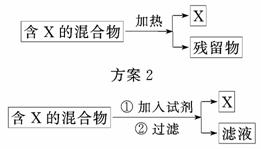
A.可以选用方案1分离碳酸氢钠中含有的氯化铵
B.方案1中残留物 应该具有的性质是受热易挥发
应该具有的性质是受热易挥发
C.方案2中加入的试剂一定能够与除X外的物质发生化学反应
D.方案2中加入NaOH溶液可以分离出SiO2和Fe2O3混合物中的Fe2O3
解析:碳酸氢钠加热分解,A错误;加热后留下的残留物一定是固体或难挥发的液体,B错误;加入的试剂可以是水且不一定发生化学反应,C错误;二氧化硅能与氢氧化钠溶液反应生成溶于水的硅酸钠,进而分离出氧化 铁,D正确.
铁,D正确.
答案:D
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com