
题目列表(包括答案和解析)
14.(2009年北京理综)以富含硫酸亚铁的工业废液为原料生产氧化铁的工艺如下(部分操作和条件略):
Ⅰ.从废液中提纯并结晶出FeSO4·7H2O。
Ⅱ.将FeSO4·7H2O配制成溶液。
Ⅲ.FeSO4溶液与稍过量的NH4HCO3溶液混合,得到含FeCO3的浊液。
Ⅳ.将浊液过滤,用90 ℃热水洗涤沉淀,干燥后得到FeCO3固体。
Ⅴ.煅烧FeCO3,得到Fe2O3固体。
已知:NH4HCO3在热水中分解。
(1)Ⅰ中,加足量的铁屑除去废液中的Fe3+,该反应的离子方程式是_________________。
(2)Ⅱ中,需加一定量硫酸。运用化学平衡原理简述硫酸的作用___________________
________________________________________________________________________。
(3)Ⅲ中,生成FeCO3的离子方程式是___________________________________________
__________________________。若FeCO3浊液长时间暴露在空气中,会有部分固体表面变为红褐色,该变化的化学方程式是_______________________________________。
(4)Ⅳ中,通过检验SO来判断沉淀是否洗涤干净,检验SO的操作是__________
________________________________________________________________________。
(5)已知煅烧FeCO3的化学方程式是4FeCO3+O22Fe2O3+4CO2。现煅烧464.0 kg的FeCO3,得到316.8 kg产品。若产品中杂质只有FeO,则该产品中Fe2O3的质量是________kg。(摩尔质量/g·mol-1:FeCO3 116 Fe2O3 160 FeO 72)
[解析] (1)注意配平。
(2)FeSO4属强酸弱碱盐,Fe2+水解,加硫酸显然是为了抑制Fe2+的水解。
(3)可分步理解:Fe2++HCO===FeCO3↓+H+,H++HCO===H2O+CO2↑。FeCO3的变化属信息方程式的书写,由Fe(OH)3的生成确定H2O、O2参与反应。
(4)属较常规的设问,平时的实验基础要扎实。
(5)FeCO3中的铁元素分别转移到Fe2O3、FeO中,根据铁元素守恒来解题。设产物中FeO、Fe2O3的物质的量分别为x、y,则:72x+106y=316.8×103,x+2y=464.0/116×103
解得:x=400 mol,y=1 800 mol,m(Fe2O3)=1 800 mol×160×10-3 kg/mol=288 kg。
[答案] (1)Fe+2Fe3+===3Fe2+
(2)加入硫酸,H+浓度增大,使Fe2++2H2OFe(OH)2+2H+的平衡向逆反应方向移动,从而抑制Fe2+的水解
(3)Fe2++2HCO===FeCO3↓+CO2↑+H2O
4FeCO3+6H2O+O2===4Fe(OH)3+4CO2
(4)取少量洗涤后的溶液放入试管中,滴加酸化的BaCl2溶液,若无白色沉淀产生,则沉淀洗涤干净
(5)288.0
13.铁单质及其化合物在生活、生产中应用广泛。请回答下列问题:
(1)钢铁在空气中发生吸氧腐蚀时,正极的电极反应式为_________________________。
(2)由于氧化性Fe3+>Cu2+,氯化铁溶液常用作印刷电路铜板腐蚀剂,反应的离子方程式是____________________。
(3)硫酸铁可作絮凝剂,常用于净水,其原理是____________________(用离子方程式表示)。在使用时发现硫酸铁不能使酸性废水中的悬浮物沉降而除去,其原因是________________________________________________________________________。
(4)磁铁矿是工业上冶炼铁的原料之一,其原理是Fe3O4+4CO3Fe+4CO2,若有1.5 mol Fe3O4参加反应,转移电子的物质的量是____________。
(5)下表中,对陈述Ⅰ、Ⅱ的正确性及其有无因果关系的判断都正确的是________(填字母)。
|
选项 |
陈述Ⅰ |
陈述Ⅱ |
判断 |
|
A |
铁是地壳中含量最高的金属元素 |
铁是人类最早使用的金属材料 |
Ⅰ对;Ⅱ对;有 |
|
B |
常温下铁与稀硫酸反应生成氢气 |
高温下氢气能还原氧化铁得到铁 |
Ⅰ对;Ⅱ对;无 |
|
C |
铁属于过渡元素 |
铁和铁的某些化合物可用作催化剂 |
Ⅰ错;Ⅱ对;无 |
|
D |
在空气中铁的表面能形成致密的氧化膜 |
铁不能与氧气反应 |
Ⅰ对;Ⅱ对;有 |
[解析] (1)钢铁在空气中发生吸氧腐蚀时,正极发生的电极反应为:O2+2H2O+4e-===4OH-。
(2)Fe3+氧化Cu而腐蚀印刷电路铜板:2Fe3++Cu===2Fe2++Cu2+。
(3)Fe3+水解产生具有吸附作用的Fe(OH)3胶体而净水:Fe3++3H2OFe(OH)3(胶体)+3H+,在酸性条件下,由于H+抑制了Fe3+的水解,无法产生Fe(OH)3胶体,故不能使悬浮物沉降除去。
(4)1 mol Fe3O4参与反应时,需4 mol CO,根据4 mol CO可得转移8 mol电子,所以1.5 mol Fe3O4参加反应时转移电子的物质的量为1.5×8 mol=12 mol。
(5)选项A,地壳中含量最高的金属元素Al元素,而不是Fe元素,由于铁是活泼金属,需通过冶炼方法获得,所以Fe不是人类最早使用的金属材料,陈述Ⅰ、Ⅱ错误,且二者没有因果关系。选项B,Fe能与稀H2SO4发生置换反应而产生H2,但在高温条件下,H2还原性很强,又能还原Fe2O3而得Fe,所以Ⅰ、Ⅱ均正确,二者无因果关系。选项C,铁是过渡元素的说法正确。选项D,铁在空气中不能形成致密的氧化膜,且Fe可与纯净的O2反应生成Fe3O4。
[答案] (1)O2+2H2O+4e-===4OH-
(2)2Fe3++Cu===2Fe2++Cu2+
(3)Fe3++3H2OFe(OH)3(胶体)+3H+ 酸性环境中,H+抑制了铁离子的水解,无法生成氢氧化铁胶体
(4)12 mol (5)B
12.下图是无机物A-M在一定条件下的转化关系(部分产物及反应条件未列出)。其中,I是由第三周期元素组成的单质中熔点最高的金属,K是一种红棕色气体。

请填写下列空白:
(1)在周期表中,组成单质G的元素位于第________周期第________族。
(2)在反应⑦中氧化剂与还原剂的物质的量之比为______。
(3)在反应②③⑥⑨中,既属于化合反应又属于非氧化还原反应的是________(填写序号)。
(4)反应④的离子方程式是__________________________________________。
(5)将化合物D与KNO3、KOH共融,可制得一种“绿色”环保高效净水剂K2FeO4(高铁酸钾),同时还生成KNO2和H2O。该反应的化学方程式是____________________________。
[解析] 解推断题的关键是“特殊”“关系”。K是一种可由氧气与L反应而得到的红棕色气体,可推知K是NO2,继而推出J溶液为硝酸溶液。由FeS2①O2A②O2B③H2OC的溶液,可推出:A为SO2,B为SO3,C为H2SO4。由于FeS2+O2―→A(SO2)+D,可知D为Fe的氧化物。由于F⑤NaOHE⑥,D,可推出:E为Fe(OH)3,D为Fe2O3。结合I为第三周期元素组成的单质中熔点最高的金属,可知I为金属铝。2Al+Fe2O32Fe+Al2O3,而G与HNO3生成NO及M溶液,则G为金属铁,H为Al2O3,M可能为Fe(NO3)2或Fe(NO3)3。由于M能与C溶液(H2SO4)反应,则M只能为Fe(NO3)2。综上所述:A为SO2,B为SO3,C为H2SO4,D为Fe2O3,E为Fe(OH)3,F的溶液为Fe2(SO4)3与Fe(NO3)3的混合溶液,G为Fe,H为Al2O3,I为Al,J为HNO3,K为NO2,L为NO,M为Fe(NO3)2。
[答案] (1)四(或4) Ⅷ (2)1∶2 (3)③
(4)3Fe2++NO+4H+===3Fe3++NO↑+2H2O
(5)Fe2O3+3KNO3+4KOH2K2FeO4+3KNO2+2H2O
11.向含有0.8 mol的稀硝酸溶液中慢慢加入22.4 g的铁粉,假设反应分为两个阶段。第一阶段为:
Fe+HNO3―→Fe(NO3)3+NO↑+H2O
(1)写出这两阶段反应的离子方程式。
(2)求这两个阶段反应中,加入铁粉的物质的量和溶液中铁元素存在的形式。
 (3)在右图中画出溶液中Fe2+、NO离子的物质的量随加入铁粉的物质的量变化的关系图象(横坐标为加入铁粉的物质的量,纵坐标是溶液中离子的物质的量)。
(3)在右图中画出溶液中Fe2+、NO离子的物质的量随加入铁粉的物质的量变化的关系图象(横坐标为加入铁粉的物质的量,纵坐标是溶液中离子的物质的量)。
[解析] 0.8 mol HNO3与0.4 mol Fe粉反应,在第一阶段Fe粉过量,第二阶段必是Fe与Fe3+反应。并且第一阶段结束,NO的量不再发生变化。
[答案] (1)Fe+4H++NO===Fe3++NO↑+2H2O,2Fe3++Fe===3Fe2+
(2)①加入铁粉为0-0.2 mol,为Fe3+;②加入铁粉为0.2-0.3 mol,为Fe2+和Fe3+;③加铁粉n(Fe)≥0.3 mol,为Fe2+。
(3)如下图

10.元素X的单质及X与Y形成的化合物能按下图所示的关系发生转化:
下列说法不正确的是
( )
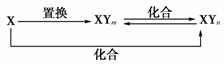
A.X可能是金属
B.X可能是非金属
C.n可以等于2或3
D.XYm与XYn的相互转化是可逆反应
[解析] X元素可以是铁:Fe+2HCl===FeCl2+H2↑,2FeCl2+Cl2===2FeCl3、2FeCl3+Fe===3FeCl2、2Fe+3Cl22FeCl3,A对;X元素可以是碳:C+H2O(g)CO+H2、2CO+O22CO2、CO2+C2CO、C+O2CO2,B对;n可以等于2或3,C对;XYm与XYn的相互转化不是可逆反应,D错。
[答案] D
9.下列物质能通过化合反应直接制得的是
( )
①FeCl2 ②H2SO4 ③NH4NO3 ④HCl
A.只有①②③ B.只有②③
C.只有①③④ D.全部
[解析] 反应举例:2FeCl3+Fe===3FeCl2;SO3+H2O===H2SO4;NH3+HNO3===NH4NO3;H2+Cl22HCl。
[答案] D
8.下列各组物质,不能按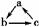 (“→”表示反应一步完成)关系转化的是
(“→”表示反应一步完成)关系转化的是
( )
|
选项 |
a |
b |
c |
|
A |
Al2O3 |
NaAlO2 |
Al(OH)3 |
|
B |
NO |
NO2 |
HNO3 |
|
C |
FeCl2 |
Fe(OH)2 |
Fe(OH)3 |
|
D |
CH2===CH2 |
CH2BrCH2Br |
CH CH CH |
[解析] Fe(OH)3无法一步生成FeCl2。
[答案] C
7.某500 mL溶液中含0.1 mol Fe2+、0.2 mol Fe3+,加入0.2 mol铁粉,待Fe3+完全还原后,溶液中Fe2+的物质的量浓度为(假设反应前后体积不变)
( )
A.0.4 mol·L-1 B.0.6 mol·L-1
C.0.8 mol·L-1 D.1.0 mol·L-1
[解析] 本题主要考查铁及其化合物的性质和有关计算。由反应2Fe3++Fe===3Fe2+可知Fe粉过量,0.2 mol Fe3+与过量Fe粉作用生成0.3 mol Fe2+,故反应后Fe2+的总物质的量为0.4 mol,溶液中c(Fe2+)==0.8 mol·L-1。
[答案] C
6.下列叙述不正确的是
( )
A.硝酸银溶液通常保存在棕色试剂瓶中,是因为硝酸银见光易分解
B.乙醇的沸点比甲醚(CH3-O-CH3)高,主要原因是乙醇分子间能形成氢键
C.反应AgCl+NaBr===AgBr+NaCl能在水溶液中进行,是因为AgBr比AgCl更难溶于水
D.常温下浓硫酸可贮存于铁制或铝制容器中,说明常温下铁和铝与浓硫酸不反应
[答案] D
5.将一定量的Fe和Fe2O3的混合物投入到250 mL 2 mol·L-1的硝酸溶液中,反应完全后,无固体剩余,生成1.12 L NO气体(标准状况),再向反应后的溶液中加入1 mol·L-1的NaOH溶液,要使铁元素全部沉淀下来,所加NaOH溶液的体积最少为
( )
A.450 mL B.500 mL
C.400 mL D.无法确定
[解析] 要使铁元素全部沉淀下来,所加NaOH溶液的体积最小,很重要的一点就是加入NaOH溶液后,无论是生成Fe(OH)2还是Fe(OH)3沉淀,剩余溶液始终为NaNO3溶液,注意Na+与NO的量的比例关系为1∶1,也就是说NaOH的物质的量与NO的物质的量相等时,使铁元素全部沉淀下来,所加NaOH溶液的体积最小。现在只需求NO的物质的量即可,故由开始加入的HNO3(物质的量为0.25 L×2 mol/L=0.5 mol)一部分变成了NO气体(其物质的量为1.12 L/22.4 L/mol=0.05 mol)剩余部分(其物质的量为0.5 mol-0.05 mol=0.45 mol)就是最终与Na+以1∶1的关系存在于溶液中的部分,即有n(NaOH)=n(NO)=0.45 mol,故NaOH溶液的体积为450 mL。
[答案] A
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com