
题目列表(包括答案和解析)
(14分)(1)已知可逆反应:M(g)+N(g)![]() P(g)+Q(g);△H>0,请回答下列问题:
P(g)+Q(g);△H>0,请回答下列问题:
①若要增大M的转化率,在其它条件不变的情况下可以采取的措施为
A、加入一定量M B、加入一定量N C、反应温度升高
D、缩小容器体积 E、加入某物质作催化剂 F、分离出一定量P
②在某温度下,反应物的起始浓度分别为:c(M)= 1 mol?L-1,c(N)=2.4 mol?L-1,达到平衡后,M的转化率为60%,此时N的转化率为 。
③若反应温度不变,反应物的起始浓度分别为:c(M)= 4 mol?L-1,c(N)=amol?L-1;达到平衡后,c(P)=2 mol?L-1,a = mol?L-1。
(2)随着科学技术的进步,人们研制出了多种类型的甲醇质子交换膜燃料电池,以满足不同的需求。
①有一类甲醇质子交换膜燃料电池,需将甲醇蒸气转化为氢气,两种反应原理是
A、CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH=+49.0kJ/mol
B、CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g) ΔH=-192.9kJ/mol
由上述方程式可知,CH3OH的燃烧热 (填“大于”、“等于”或“小于”)192.9kJ/mol。已知水的气化热为44 kJ/mol,则氢气燃烧热的热化学方程式为 。
②下图是某笔记本电脑用甲醇质子交换膜燃料电池的结构示意图。甲醇在催化剂作用下提供质子和电子,电子经外电路、质子经内电路到达另一极与氧气反应,电池总反应为:2CH3OH+3O2=2CO2+4H2O。则c电极是 (填“正极”或“负极”),c电极上发生的电极反应是 。
 |
(8分)在体积为2 L的密闭容器中,充入lmol CO2和2.6mol H2,一定条件下发生反应:
CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H= ―49.0 kJ?mol-1
CH3OH(g)+H2O(g) △H= ―49.0 kJ?mol-1
测得CO2和CH3OH(g)的浓度随时间变化如右图所示:
(1)从反应开始到第10 min,氢气的平均反应速率v(H2)= ,在这段时间内,反应放出的热量= 。
(2)在该条件下,反应的平衡常数K的值 = ,如果在某一时刻保持温度不变,只改变浓度,使c(CO2) =1.00 mol/L,c(H2) = 2.00 mol/L,c(CH3OH) = c(H2O) = 0.80 mol/L,则平衡 (填写序号)。
a.向正反应方向移动 b.向逆反应方向移动 c.不移动 d.无法确定平衡移动方向
(3)下列措施中能使n(CH3OH)/n(CO2)增大的是 (填写序号)。
a.升高温度 b.充入He(g),使体系压强增大
c.将H2O(g)从体系中分离 d.再充入l mol CH3OH(g)
(4)在催化剂的作用下,CO2与H2能够合成许多物质,如甲醇、烃类、二甲醚等,但反应体系中若混入杂质,则反应很难进行,可能的原因是 。
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g); △H= + 49.0 kJ?mol-1
②CH3OH(g)+1/2O2(g)=CO2(g)+2H2(g);△H=-192.9 kJ?mol-1下列说法正确的是
A.CH3OH的燃烧热为192.9 kJ?mol-1
B.反应①中的能量变化如右图所示
C.CH3OH转变成H2的过程一定要吸收能量
D.根据②推知反应: CH3OH(l)+1/2O2(g)=CO2(g)+2H2(g)的△H>-192.9kJ?mol-1
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g); △H= + 49.0 kJ?mol-1
②CH3OH(g)+1/2O2(g)=CO2(g)+2H2(g);△H=-192.9 kJ?mol-1下列说法正确的是( )
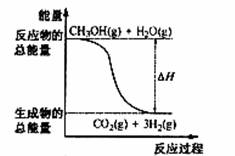
A.CH3OH的燃烧热为192.9 kJ?mol-1
B.反应①中的能量变化如上图所示
C.CH3OH转变成H2的过程一定要吸收能量
D.根据②推知反应:CH3OH(l)+1/2O2(g)=CO2(g)+2H2(g)的△H>-192.9kJ?mol-1
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g); △H= + 49.0 kJ?mol-1
②CH3OH(g)+1/2O2(g)=CO2(g)+2H2(g);△H= -192.9 kJ?mol-1
下列说法正确的是( )
A.CH3OH的燃烧热为192.9 kJ?mol-1
B.反应①中的能量变化如下图所示

C.CH3OH转变成H2的过程一定要吸收能量
D.根据②推知反应:CH3OH(l)+1/2O2(g)=CO2(g)+2H2(g)的△H>-192.9kJ?mol-1
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com