
题目列表(包括答案和解析)
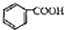 )和石灰的混合物得到苯,写出苯甲酸钠与碱石灰(其中的NaOH参与反应)共热生成苯的化学方程式
)和石灰的混合物得到苯,写出苯甲酸钠与碱石灰(其中的NaOH参与反应)共热生成苯的化学方程式 )脱去2mol氢原子变成苯却放热,可推断苯比1,3-环己二烯
)脱去2mol氢原子变成苯却放热,可推断苯比1,3-环己二烯
 某学生用邻苯二甲酸氢钾(相对分子质量为204)测定NaOH溶液的浓度,若NaOH溶液的浓度在0.1mol/L左右,滴定终点时溶液的pH约为9.1.
某学生用邻苯二甲酸氢钾(相对分子质量为204)测定NaOH溶液的浓度,若NaOH溶液的浓度在0.1mol/L左右,滴定终点时溶液的pH约为9.1.

| 实验编号 | 邻苯二甲酸氢钾的质量(g) | 待测NaOH溶液的体积(mL) |
| 1 | 0.4162 | 18.25 |
| 2 | 17.04 | |
| 3 | 16.96 |
| 实验编号 | 邻苯二甲酸氢钾的质量(g) | 待测NaOH溶液的体积(mL) |
| 1 | 0.4162 | 18.25 |
| 2 | 17.04 | |
| 3 | 16.96 |

(12分)实验室常用准确称量的邻苯二甲酸氢钾(结构简式如图所示)来准确测定NaOH标准溶液的浓度,即分析化学实验中常称为“标定”的一种方法。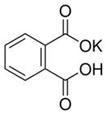
已知:①NaOH溶液的浓度在0.1 mol·L-1左右,滴定终点时溶液的pH应为9.1。
②邻苯二甲酸氢钾相对分子质量为204
(1)写出邻苯二甲酸氢钾与NaOH反应的离子方程式________________________。
(2)将用托盘天平称好的邻苯二甲酸氢钾放于锥形瓶中,加适量的水溶解,溶液呈无色,
再加入指示剂______(从甲基橙、酚酞中选择),用NaOH溶液滴定到终点时,现象是____________。
某学生进行了四次实验,实验数据如下表:
| 实验编号 | 邻苯二甲酸氢钾的质量(g) | 待测NaOH溶液的体积(mL) |
| 1 | 0.4080 | 18.20 |
| 2 | 17.10 | |
| 3 | 16.90 | |
| 4 | 17.00 |
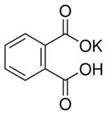
(12分)实验室常用准确称量的邻苯二甲酸氢钾(结构简式如图所示)来准确测定NaOH标准溶液的浓度,即分析化学实验中常称为“标定”的一种方法。
已知:①NaOH溶液的浓度在0.1 mol·L-1左右,滴定终点时溶液的pH应为9.1。
②邻苯二甲酸氢钾相对分子质量为204
(1)写出邻苯二甲酸氢钾与NaOH反应的离子方程式________________________。
(2)将用托盘天平称好的邻苯二甲酸氢钾放于锥形瓶中,加适量的水溶解,溶液呈无色,
再加入指示剂______(从甲基橙、酚酞中选择),用NaOH溶液滴定到终点时,现象是____________。
某学生进行了四次实验,实验数据如下表:
|
实验编号 |
邻苯二甲酸氢钾的质量(g) |
待测NaOH溶液的体积(mL) |
|
1 |
0.4080 |
18.20 |
|
2 |
17.10 |
|
|
3 |
16.90 |
|
|
4 |
17.00 |
(3)滴定中误差较大的是第________次实验,造成这种误差的可能原因是____________。
A.碱式滴定管在装液前未用待测NaOH溶液润洗2~3次
B.滴定开始前碱式滴定管尖嘴部分有气泡,在滴定终点读数时未发现气泡
C.盛有邻苯二甲酸氢钾溶液的锥形瓶中有少量水
D.达到滴定终点时,俯视溶液凹液面最低点读数
E.滴定过程中,锥形瓶摇荡得太剧烈,以至有些液滴飞溅出来
F.滴定到终点时,溶液颜色由无色变到了红色
(4)该同学所测得的NaOH溶液的物质的量浓度为________ mol·L-1(结果保留三位小数)。
1-8 B A A C B C C D
9-14 D BC C AD B CD
15.(10分)
⑴<(1分)
⑵K =  变小 正反应放热,升高温度,平衡逆向移动,常数减小 (1+1+2分)
变小 正反应放热,升高温度,平衡逆向移动,常数减小 (1+1+2分)
⑶减小 不变 (1+1分)
⑷> 压强增大后,C可能已经液化或者固化 (1+2分)
16.(13分)
⑴略(2分)
⑵酚酞 无色变成浅红色(2分)
⑶碱式滴定管 锥形瓶(2分)
⑸1 滴定管只用水洗,未用NaOH润洗 滴定前滴定管尖嘴处有气泡,滴定后消失 滴定终点判断不准,溶液呈红色(其他合理答案也可以)(1+2 + 2分)
⑹0.1200mol/L (有效数字1分)(2分)
17.(9分)
⑴还原 使与空气充分接触将MnO2充分氧化(1+ 2分)
⑵2H+ + 2e― = H2↑(或2H2O + 2e― = H2↑+ 2OH―) MnO42― ― e― = MnO4―
2K2MnO4
+ 2H2O  2KMnO4 + 2KOH + H2↑(2+2+2分)
2KMnO4 + 2KOH + H2↑(2+2+2分)
18.(10分)
⑴略 H2O2 + SO2 = H2SO4(1+ 2分)
⑵HS―+ H2O H2S
+ OH―(2分)
H2S
+ OH―(2分)
⑶H+ + HSO3― = H2O + SO2↑(2分)
⑷负 O2 + 2H2O + 4e― = 4OH―(1+ 2分)
19.(9分)
⑴2Al2O3 4Al+3O2↑(2分)
4Al+3O2↑(2分)
⑵2Al+2OH―+2H2O=2AlO2-+3H2↑(2分)
⑶①4OH--4e-=2H2O+O2↑(2分)
②H+放电,促进水的电离,OH-浓度增大(2分)
③B(1分)
20.(12分)
⑴碱性 A2―将发生水解 A2―+ H2O  HA― + OH―(1+ 2分)
HA― + OH―(1+ 2分)
⑵ABCD(4分 少1个,扣2分,少2个扣3分,只答对1个或未答0分)
⑶< H
⑷c(Na+)> c(HA―)> c(H+)> c(A2―)> c(OH―) (2分)
21.(9分)
小(2分)
⑴D 混合物中有砖红色沉淀生成(1+ 2分)
⑵由AgCl、Ag2CrO4的溶度积常数计算可知道,AgCl溶解度更小,加硝酸银
所以当Cl―全部被消耗时,混合体系的总体积约为40mL,此时
c(CrO42―) =  =5.26×10―4 mol/L
=5.26×10―4 mol/L
c(Ag+) =  =6×10―5 mol/L(AgNO3过量很少即可)
=6×10―5 mol/L(AgNO3过量很少即可)
c(Cl―) =  = 3×10―6 mol/L
< 1×10―5 mol/L(Cl―沉淀完全)(4分)
= 3×10―6 mol/L
< 1×10―5 mol/L(Cl―沉淀完全)(4分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com