
题目列表(包括答案和解析)



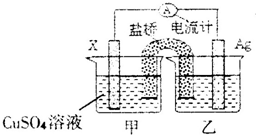 (1)将反应2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)设计成原电池其装置如图.电极X的材料是
(1)将反应2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)设计成原电池其装置如图.电极X的材料是
某化工厂利用含铁的矿物质A制取水合盐G的流程如图所示。已知:B中氧元素的质量分数为30%,气体C是形成酸雨的污染物之一。
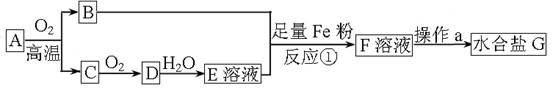
(1) A中主要成分的化学式可能为 (只写一种)。
(2)操作a过程中 (能、不能)将F溶液直接蒸干。
(3)确认F溶液中不含有Fe3+的方法是___________ ___。
(4)反应①中存在多种反应,请写出其中属于非氧化还原反应的离子方程式
___ ___。
(5)工业上反应C→D的化学方程式是_________ _____。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com