
题目列表(包括答案和解析)
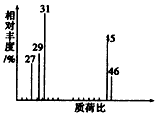
 2C(g)达到平衡时,测得容器中含有A 1mol B 0.4mol,C 0.4mol,此时容积为2L.则A的起始投入量为
2C(g)达到平衡时,测得容器中含有A 1mol B 0.4mol,C 0.4mol,此时容积为2L.则A的起始投入量为(1)Ag+HNO3——AgNO3+NO↑+H2O
(2)Cl2+NaOH![]() NaCl+NaClO3+H2O
NaCl+NaClO3+H2O
(3)KMnO4+FeSO4+H2SO4——Fe2(SO4)3+K2SO4+MnSO4+H2O
(4)NH4NO3——N2↑+HNO3+H2O
(5)Cu2S+HNO3——Cu(NO3)2+NO↑+H2SO4+H2O
(6)![]() +H2S+H+——Mn2++
+H2S+H+——Mn2++![]() +H2O
+H2O
(7)![]() +I-+H+——Cr3++I2+H2O
+I-+H+——Cr3++I2+H2O
(8)Pt+HNO3+HCl—H2PtCl6+NO↑+![]()
(9)Fe2++ClO-+![]() ——Fe(OH)3↓+Fe3++Cl-
——Fe(OH)3↓+Fe3++Cl-

| 实验序号 | 甲针筒内物质 | 乙针筒内物质 | 甲针筒的现象 |
| 1 | 40mL HCl | 40mL NH3 | 产生白烟 |
| 2 | 40mL Cl2 | 10mL水 | 剩余气体为20mL |
| 3 | 30mL NO | 15mL O2 | |
| 4 | 20mL AlCl3溶液 | 10mL NaOH溶液 | 生成白色沉淀,后消失 |

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com