
题目列表(包括答案和解析)
| 实验步骤 | 实验现象 |
| ①将氯水滴加到NaBr溶液中,振荡后再加入适量CCl4,振荡,静置 | A、浮在水面上,熔成小球,不定向移动,随之消失 |
| ②将一小块金属钠放入到冷水中 | B、分层,上层无色,下层紫红色 |
| ③将溴水滴加到NaI溶液中,振荡后再加入适量 CCl4,振荡,静置 | C、浮在水面上,熔成小球,不定向移动,并伴有轻微的爆炸声,很快消失 |
| ④将一小块金属钾放入冷水中 | D、分层,上层无色,下层橙红色 |
| 实验内容 | 实验现象 | 化学方程式 |
| ① | D D |
Cl2+2NaBr═2NaCl+Br2 Cl2+2NaBr═2NaCl+Br2 |
| ② | A A |
2Na+2H2O═2NaOH+H2↑ 2Na+2H2O═2NaOH+H2↑ |
| ③ | B B |
Br2+2NaI═2NaBr+I2 Br2+2NaI═2NaBr+I2 |
| ④ | C C |
2K+2H2O═2KOH+H2 2K+2H2O═2KOH+H2 |


 已知A、B、C、D、E、F为周期表前四周期原子序数依次增大的六种元素.其中A是元素周期表中原子半径最小的元素,B原子最外层电子数是内层电子数的2倍.D、E为同主族元素,且E的原子序数为D的2倍.F元素在地壳中含量位于金属元素的第二位.试回答下列问题:
已知A、B、C、D、E、F为周期表前四周期原子序数依次增大的六种元素.其中A是元素周期表中原子半径最小的元素,B原子最外层电子数是内层电子数的2倍.D、E为同主族元素,且E的原子序数为D的2倍.F元素在地壳中含量位于金属元素的第二位.试回答下列问题:



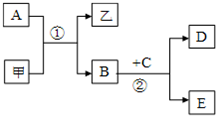 图所示的转化关系中,甲、乙及A、B、C、D、E均为中学常见的化学物质,其中甲、乙为化合物,A、B、D为单质.
图所示的转化关系中,甲、乙及A、B、C、D、E均为中学常见的化学物质,其中甲、乙为化合物,A、B、D为单质.
| ||
| ||
| ||
| ||
 有A、B、C、D、E五种短周期元素,其原子序数依次增大.A原子的电子层数与它的核外电子总数相同,B原子核外最外层电子数是次外层电子数的2倍,C元素的原子基态时2p能级是2s能级上的电子数的2倍,D是该周期中原子半径最大的主族元素,E原子的第一至第四电离能(kJ?mol-1)分别为:578、1817、2745、11575.请回答下列问题:
有A、B、C、D、E五种短周期元素,其原子序数依次增大.A原子的电子层数与它的核外电子总数相同,B原子核外最外层电子数是次外层电子数的2倍,C元素的原子基态时2p能级是2s能级上的电子数的2倍,D是该周期中原子半径最大的主族元素,E原子的第一至第四电离能(kJ?mol-1)分别为:578、1817、2745、11575.请回答下列问题:湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com