
题目列表(包括答案和解析)
A、B、C、D、E、F六种元素,其中A、B、C、D、E为短周期主族元素。它们之间的关系如下:
(Ⅰ)原子半径:A < C < B < E < D
(Ⅱ)原子的最外层电子数:A = D, C = E, A+B = C。
(Ⅲ)原子的核外电子层数:B = C = 2A
(Ⅳ)B元素的主要化合价:最高正价+最低负价 = 2
(Ⅴ)F的单质或合金是用量最大的金属材料。
请回答:(1)甲由A、B两种元素按原子数之比为3:1组成的物质,写出其电子式 ;
(2)写出某含F黑色的磁性氧化物与B最高价氧化物对应水化物的稀溶液反应的离子方程式: 。
(3)由A、C、E三种元素组成的两种气体化合物,相互反应能生成淡黄色固体的化学反应方程式为: 。
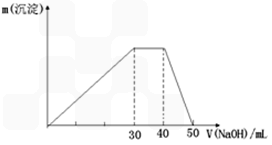
(4)上述元素中A、B、C、E、F的五种元素可形成一种常见复盐,经检测该复盐由三种离子组成且离子个数比为1:1:2,向该盐溶液加入酸化的BaCl2溶液,产生白色沉淀;加入NaOH溶液并加热,产生能使湿润红色石蕊试纸变蓝的气体,则该复盐的化学式为 。为检验该复盐中的某种有色离子存在,请写出实验的操作步骤和现象 ;
(5)将上述复盐配成0.1L 0.1mol/L的溶液,向其中加入0.06mol的BaCl2固体完全反应后,该溶液中c(SO42-)为: (已知:忽略溶液体积变化。该沉淀的Ksp=2×10-9)
![]()
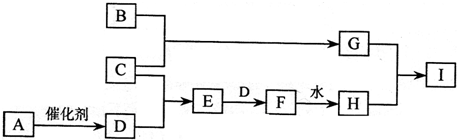
(1)若A 是一种溶液,其溶质由三种不同短周期元素构成,这三种元素中有两种处于同一主族,且三种元素原子的最外层电子数之和为8,则X的化学式可能为____________、____________(填两种不同类别的物质);若此时X为一种18电子的分子, 则C的化学式为____________,在B的溶液中加入新制的AgCl悬浊液,白色浑浊立即变成黑色浑浊,由此现象可以得出的结论是____________________________________。
(2)若A是一种10电子分子,B在通常情况下遇X即生成C,又知
(3)若A是一种黄色的固体非金属单质,则反应②的化学方程式是_________________。
某温度T时,在一定条件下的
①物质B的转化率____________________________________。
②该温度下反应②的平衡常数____________________________________。
③在上述相同的条件下,向相同的容器中投入2 mol C,请在右下图中画出从反应开始至t2时间达到平衡后各物质的物质的量与时间的关系图。

(8分)A—E五种元素中,除A、B外其他均为短周期元素它们的性质或原子结构如下表:
| 元素 | 元素性质或原子结构 |
| A | 单质为生活中常见的金属,该金属的两种黑色氧化物(其中一种有磁性)的相对分子质量相差160 |
| B | 单质为生活中常见的金属,其相对原子质量比A大8 |
| C | 地壳中含量最多的金属元素 |
| D | 元素的主族序数是其所在周期序数的3倍 |
| E | E的某种原子的原子核内没有中子 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com