
![]()
(1)��A ��һ����Һ�������������ֲ�ͬ������Ԫ�ع��ɣ�������Ԫ���������ִ���ͬһ���壬������Ԫ��ԭ�ӵ�����������֮��Ϊ8����X�Ļ�ѧʽ����Ϊ____________��____________(�����ֲ�ͬ��������)������ʱXΪһ��18���ӵķ��ӣ� ��C�Ļ�ѧʽΪ____________����B����Һ�м������Ƶ�AgCl����Һ����ɫ����������ɺ�ɫ���ǣ��ɴ�������Եó��Ľ�����____________________________________��
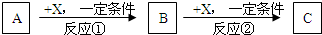
(2)��A��һ��10���ӷ��ӣ�B��ͨ���������X������C����֪
(3)��A��һ�ֻ�ɫ�Ĺ���ǽ������ʣ���Ӧ�ڵĻ�ѧ����ʽ��_________________��
ij�¶�Tʱ����һ�������µ�
������B��ת����____________________________________��
�ڸ��¶��·�Ӧ�ڵ�ƽ�ⳣ��____________________________________��
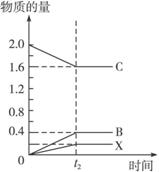
����������ͬ�������£�����ͬ��������Ͷ��2 mol C����������ͼ�л����ӷ�Ӧ��ʼ��t2ʱ��ﵽƽ�������ʵ����ʵ�����ʱ��Ĺ�ϵͼ��

(1)CO2 H2SO3(AlCl3��H2S��Ⱥ�����) NaHS Ag2S���ܽ�ȱ�AgCl��С
(2)4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g)����H=-906.8 kJ��mol-1
4NO(g)+6H2O(g)����H=-906.8 kJ��mol-1
(3)2SO2+ O2![]() 2SO3
2SO3
��80% ��160 ������ͼ

������A��NaOH����ʱX������CO2��AlCl3(��H2S��H2SO3��)����XΪ18���ӷ���H2S����CΪNaHS�����Եó�Ag2S���ܽ��С��AgCl���ܽ�ȡ�
(2)4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) ��H=-906.8 kJ��mol-1��
4NO(g)+6H2O(g) ��H=-906.8 kJ��mol-1��
(3)AΪS��BΪSO2��CΪSO3��
2SO2+O2![]() 2SO3
2SO3
�٦�(SO2)=![]() ��100 %=80%
��100 %=80%
��K=![]() =
=
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

| ���� |
| �� |
| ���� |
| �� |


�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

| ||
| ||
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ����3�ֻ�����A��B��C����������Ԫ��R����ת����ϵ��ͼ��ʾ��
����3�ֻ�����A��B��C����������Ԫ��R����ת����ϵ��ͼ��ʾ��

| ||
| �� |
| ||
| �� |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com