
题目列表(包括答案和解析)
 Cu2+能与NH3、H2O、OH-、Cl-等形成配位数为4的配合物.
Cu2+能与NH3、H2O、OH-、Cl-等形成配位数为4的配合物.


某铜矿石主要含Cu2(OH)2CO3,还含少量Fe、Si的化合物。实验室以此铜矿石为原料制备CuSO4·5H2O及CaCO3,部分步骤如下:
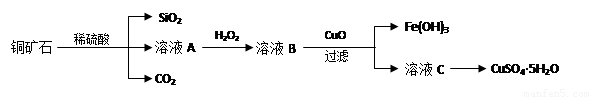
请回答下列问题:
(1)溶液A除含有Cu2+外,还可能含有的金属离子有________(填离子符号);在溶液A中加入H2O2反应的离子方程式是______________。
(2)可用生成的CO2制取优质碳酸钙。制备时,先向氯化钙溶液中通入氨气,再通入CO2。
①实验室通常采用加热氯化铵和氢氧化钙混合物的方法制取氨气。某学习小组选取下图所给部分装置制取并收集纯净的氨气。

如果按气流方向连接各仪器接口,你认为正确的顺序为a→______、______→______、______→ i。其中与i相连漏斗的作用是______________。
②实验室中还可用固体氢氧化钠和浓氨水制取少量氨气,下列最适合完成该实验的简易装置是
_________(填编号)

(3)测定铜矿石中Cu2(OH)2CO3质量百分含量的方法是:a.将1.25g铜矿石制取的CuSO4·5H2O于锥形瓶中,加入适量水完全溶解;b.向溶液中加入100mL0.25mol/L的氢氧化钠溶液使Cu2+完全沉淀;c.过滤;d.滤液中的氢氧化钠溶液用0.5mol/L盐酸滴定至终点,耗用10mL盐酸。则铜矿石中Cu2(OH)2CO3质量分数为_____________。
某铜矿石主要含Cu2(OH)2CO3,还含少量Fe、Si的化合物。实验室以此铜矿石为原料制备CuSO4·5H2O 及CaCO3,部分步骤如下:

请回答下列问题:
(1)溶液A除含有Cu2+外,还可能含有的金属离子有________(填离子符号),验证所含离子所用的试剂是______________。
(2)可用生成的CO2制取优质碳酸钙。制备时,先向氯化钙溶液中通入氨气,再通入CO2。
①实验室通常采用加热氯化铵和氢氧化钙混合物的方法制取氨气。某学习小组选取下图所给部分装置制取并收集纯净的氨气。

如果按气流方向连接各仪器接口,你认为正确的顺序为a→______、______→______、______→ i。其中与i相连漏斗的作用是______________。
②实验室中还可用固体氢氧化钠和浓氨水制取少量氨气,下列最适合完成该实验的简易装置是_________(填编号)

(3)测定铜矿石中Cu2(OH)2CO3质量百分含量的方法是:a.将1.25g铜矿石制取的CuSO4·5H2O于锥形瓶中,加入适量水完全溶解;b.向溶液中加入100mL0.25mol/L的氢氧化钠溶液使Cu2+完全沉淀;c.过滤;d.滤液中的氢氧化钠溶液用0.5mol/L盐酸滴定至终点,耗用10mL盐酸。则铜矿石中Cu2(OH)2CO3质量分数为_____________。
某铜矿石主要含Cu2(OH)2CO3,还含少量Fe、Si的化合物。实验室以此铜矿石为原料制备CuSO4·5H2O及CaCO3,部分步骤如下: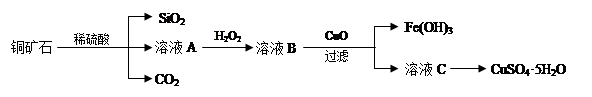
请回答下列问题:
(1)溶液A除含有Cu2+外,还可能含有的金属离子有________(填离子符号);在溶液A中加入H2O2反应的离子方程式是______________。
(2)可用生成的CO2制取优质碳酸钙。制备时,先向氯化钙溶液中通入氨气,再通入CO2。
①实验室通常采用加热氯化铵和氢氧化钙混合物的方法制取氨气。某学习小组选取下图所给部分装置制取并收集纯净的氨气。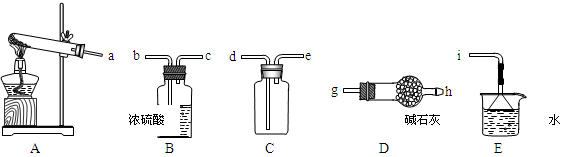
如果按气流方向连接各仪器接口,你认为正确的顺序为a→______、______→______、______→ i。其中与i相连漏斗的作用是______________。
②实验室中还可用固体氢氧化钠和浓氨水制取少量氨气,下列最适合完成该实验的简易装置是
_________(填编号)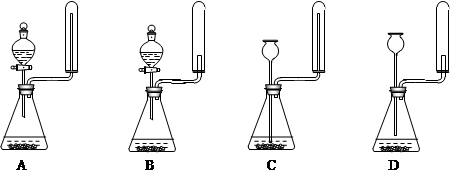
(3)测定铜矿石中Cu2(OH)2CO3质量百分含量的方法是:a.将1.25g铜矿石制取的CuSO4·5H2O于锥形瓶中,加入适量水完全溶解;b.向溶液中加入100mL0.25mol/L的氢氧化钠溶液使Cu2+完全沉淀;c.过滤;d.滤液中的氢氧化钠溶液用0.5mol/L盐酸滴定至终点,耗用10mL盐酸。则铜矿石中Cu2(OH)2CO3质量分数为_____________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com