
题目列表(包括答案和解析)
| ||
| ||
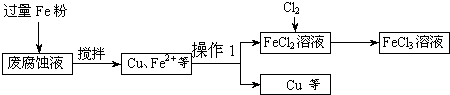
(本题12分)印刷电路的废腐蚀液含有大量CuCl2、FeCl2和FeCl3,任意排放将导致环境污染及资源的浪费。可从该废液中回收铜,并将铁的化合物全部转化为FeCl3溶液,作为腐蚀液原料循环使用。测得某废腐蚀液中含CuCl2 1.5mol/L,含FeCl2 3.0mol/L,含FeCl3 1.0mol/L,含HCl 3.0mol/L。取废腐蚀液200mL按如下流程在实验室进行实验:
![]()

回答下列问题:
(1)上述方法获得的铜粉中含有杂质,除杂所需试剂是
(填化学式)。
(2) 实验室可用固体KClO3与浓HCl反应制备Cl2,此反应中Cl2既是氧化产物,又是还原产物。反应的化学方程式为 。
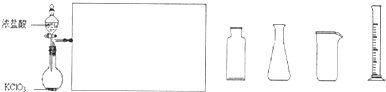
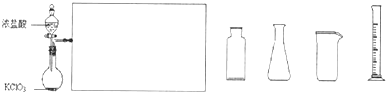
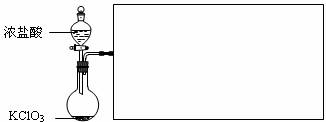
![]() ⑶ 下图是实验室制备Cl2并通入FeCl2溶液中获得FeCl3溶液的部分装置。
⑶ 下图是实验室制备Cl2并通入FeCl2溶液中获得FeCl3溶液的部分装置。
![]()


![]()
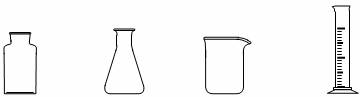
![]() 从下图挑选所需的仪器,完成上述装置简图(添加必要的塞子、玻璃导管、胶皮管。固定装置不用画),并标明容器中所装试剂。
从下图挑选所需的仪器,完成上述装置简图(添加必要的塞子、玻璃导管、胶皮管。固定装置不用画),并标明容器中所装试剂。
![]()


![]() ⑷ 实验中,必需控制氯气的速度,使导管口逸出的气泡每秒1~2个,以便被FeCl2溶液完全吸收。控制生成氯气速度的操作是: 。
⑷ 实验中,必需控制氯气的速度,使导管口逸出的气泡每秒1~2个,以便被FeCl2溶液完全吸收。控制生成氯气速度的操作是: 。
![]() ⑸ 按上述流程操作,需称取Fe粉的质量应不少于 g(精确到0.1g),需通入Cl2的物质的量不少于 mol,加入烧瓶中的KClO3的质量应不少于 g(精确到0.1g)。
⑸ 按上述流程操作,需称取Fe粉的质量应不少于 g(精确到0.1g),需通入Cl2的物质的量不少于 mol,加入烧瓶中的KClO3的质量应不少于 g(精确到0.1g)。
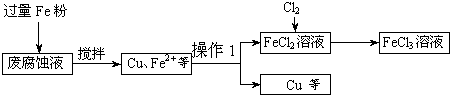
印刷电路的废腐蚀液含有大量CuCl2、FeCl2和FeCl3,任意排放将导致环境污染及资源的浪费。可从该废液中回收铜,并将铁的化合物全部转化为FeCl3溶液,作为腐蚀液原料循环使用。测得某废腐蚀液中含CuCl2 1.5mol/L,含FeCl2 3.0mol/L,含FeCl3 1.0mol/L,含HCl 3.0mol/L。取废腐蚀液200mL按如下流程在实验室进行实验:

回答下列问题:
(1)上述方法获得的铜粉中含有杂质,除杂所需试剂是 (填化学式)。
(2)实验室可用固体KClO3与浓HCl反应制备Cl2,此反应中Cl2既是氧化产物,又是还原产物。反应的化学方程式为 。
(3)下图是实验室制备Cl2并通入FeCl2溶液中获得FeCl3溶液的部分装置。
从下图挑选所需的仪器,完成上述装置简图(添加必要的塞子、玻璃导管、胶皮管。固定装置不用画),并标明容器中所装试剂。
(4)实验中,必需控制氯气的速度,使导管口逸出的气泡每秒1~2个,以便被FeCl2溶液完全吸收。控制生成氯气速度的操作是: 。
(5)按上述流程操作,需称取Fe粉的质量应不少于 g(精确到0.1g),需通入Cl2的物质的量不少于 mol,加入烧瓶中的KClO3的质量应不少于 g(精确到0.1g)。
①称取W g纯草酸晶体,将其配制成100.0 mL水溶液为待测液。
②取25.0 mL待测液放入锥形瓶中,再加入适量的稀H2SO4。
③用浓度为a mol·L-1的KMnO4标准溶液进行滴定,滴定时发生的反应为:
2KMnO4+5H2C2O4+3H2SO4===K2SO4+2MnSO4+10CO2↑+8H2O
请回答:
(1)滴定时,将KMnO4标准液装在_________滴定管中,操作时用_________手拿锥形瓶。
(2)若滴定时所用的KMnO4溶液因久置而导致浓度变小,则由此测得的x值会_________(填“偏大”“偏小”或“不变”)。
(3)假设滴定终点时,用去V mL KMnO4溶液,则待测草酸溶液的物质的量浓度为_________mol·L-1。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com