
题目列表(包括答案和解析)
(12分)
(1)已知H2A在水中存在以下电离:H2A H++HA-,HA-
H++HA-,HA- H++A2-。回答问题:
H++A2-。回答问题:
①NaHA溶液呈 (填“酸性”、“碱性”、“中性”或“无法确定”),
②某温度下,向0.1mol·L-1的NaHA溶液中滴入0.1mol·L-1KOH溶液至中性,此时溶液中以下关系一定正确的是 (填字母)。
A.c(H+)· c(OH-) =1×10-14
B.c(Na+)+c(K+)=2c(A2-)+c(HA-)
C.c(Na+)=0.05mol ·L-1
D.c(Na+)= c(A2-)+c(HA-) +c(H2A)
(2)已知常温下:CaA(s) Ca2+(aq)+A2-(aq);△H>0,c(Ca2+)·c(A2—)为常数,记作:
Ca2+(aq)+A2-(aq);△H>0,c(Ca2+)·c(A2—)为常数,记作:
Ksp=c(Ca2+)·c(A2—)。试回答:
①温度升高时,Ksp (填“增大”、“减小”或“不变”,下同)
②滴加少量浓盐酸,c(Ca2+) ,原因是
(3)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10—9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10—4mo1/L ,则生成沉淀所需CaCl2溶液的最小浓度为 。
 H++HA-,HA-
H++HA-,HA- H++A2-。回答问题:
H++A2-。回答问题: Ca2+(aq)+A2-(aq);△H>0,c(Ca2+)·c(A2—)为常数,记作:
Ca2+(aq)+A2-(aq);△H>0,c(Ca2+)·c(A2—)为常数,记作:常温下,向20mL0.2mol/LH2A溶液中滴加0.2mol/LNaOH溶液。有关微粒的物质的量变化如下图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-)根据下图图示判断,下列说法错误的是( )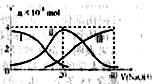
A.当V(NaOH)=20mL时,溶液中离子浓度大小关系:c(Na+)>c(HAˉ)>c(H+)> c(A2-)>c(OHˉ)
B.等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水的大
C.NaHA溶液中:c(OH-)+c(A2–)=c(H+)+c(H2A)
D.向Na2A溶液加入水的过程中,pH减小
常温下,向20mL0.2mol/LH2A溶液中滴加0.2mol/LNaOH溶液。有关微粒的物质的量变化如下图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-)根据下图图示判断,下列说法错误的是( )

A.当V(NaOH)=20mL时,溶液中离子浓度大小关系:c(Na+)>c(HAˉ)>c(H+)> c(A2-)>c(OHˉ)
B.等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水的大
C.NaHA溶液中:c(OH-)+c(A2–)=c(H+)+c(H2A)
D.向Na2A溶液加入水的过程中,pH减小
6B 7C 8D 9C 10B 11B 12A 13D
26 . ( 16 分)( 1 )第三(1 分)IA ( 1 分) ( 2 ) Na > N > H ( 2 分)
( 3 )正四面体结构(l 分)极性共价键(1 分)极性(1 分)
C2A2的电子式: ( 2 分)
( 2 分)

( 2 )防止碳酸钠液体倒吸,便于乙酸乙酯流出 ( 2 分)
( 3 ) I 98 %的浓硫酸具有强氧化性,使部分反应物炭化 ( 2 分)

II ① ② ③ (2 分,答一个且正确得1 分,有错不得分)10 mol?L一1 ( 2 分)
III 能(1 分)因为酯化反应的催化剂是H+,盐酸也能电离出H+ (2 分)
说明:1.本试卷中其它合理答案,可参照此评分标准酌情给分。
2.方程式未写条件或条件不完全、不写“↓”或“↑”均扣一分,不配平不得分。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com