
题目列表(包括答案和解析)
(1)该工厂为什么将废气以5 m3/h的速率与速率为20 L·h-1的氨气混合为最佳配比(用计算说明)?
(2)该厂若每天排放10000 m3的这种废气,按上述方法,该厂每月(按30天计算)可得到硫酸铵多少吨?消耗氨气多少立方米?
| ||
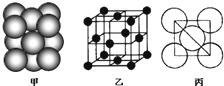



 (2010?柳州三模)A、B、C、D是由前18号元素组成的四种常见化合物,D为红棕色气体,甲、乙是两种单质,这些单质和化合物之间存在如图反应关系:
(2010?柳州三模)A、B、C、D是由前18号元素组成的四种常见化合物,D为红棕色气体,甲、乙是两种单质,这些单质和化合物之间存在如图反应关系:| 1 |
| 2 |
| 1 |
| 2 |
6B 7C 8D 9C 10B 11B 12A 13D
26 . ( 16 分)( 1 )第三(1 分)IA ( 1 分) ( 2 ) Na > N > H ( 2 分)
( 3 )正四面体结构(l 分)极性共价键(1 分)极性(1 分)
C2A2的电子式: ( 2 分)
( 2 分)

( 2 )防止碳酸钠液体倒吸,便于乙酸乙酯流出 ( 2 分)
( 3 ) I 98 %的浓硫酸具有强氧化性,使部分反应物炭化 ( 2 分)

II ① ② ③ (2 分,答一个且正确得1 分,有错不得分)10 mol?L一1 ( 2 分)
III 能(1 分)因为酯化反应的催化剂是H+,盐酸也能电离出H+ (2 分)
说明:1.本试卷中其它合理答案,可参照此评分标准酌情给分。
2.方程式未写条件或条件不完全、不写“↓”或“↑”均扣一分,不配平不得分。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com