
题目列表(包括答案和解析)
| 编号 | 温度 | 大理石规格 | HNO3浓度 /mol?L-1 |
实验目的 |
| ① | 25℃ | 粗颗粒 | 2.00 | (I)实验①和②探究硝酸浓度对该反应速率的影响; (II)实验①和 ③ ③ 探究温度对该反应速率的影响;(Ⅲ)实验①和 ④ ④ 探究大理石规格(粗、细)对该反应速率的影响. |
| ② | 25℃ | 粗颗粒 粗颗粒 |
1.00 1.00 | |
| ③ | 35℃ | 粗颗粒 粗颗粒 |
2.00 2.00 | |
| ④ | 25℃ | 细颗粒 细颗粒 |
2.00 2.00 |
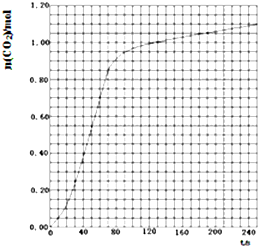
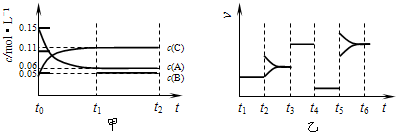
| t | 2 |
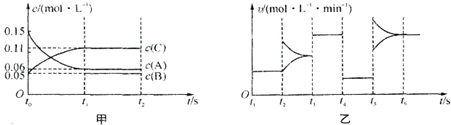
| A、若t0=15 s,则用C的浓度变化表示的t0~t1段的平均反应速率为0.004mol?L-1?s-1 |
| B、t4~t5阶段改变的条件一定为减小压强 |
| C、该容器的容积为2 L,B的起始物质的量为0.02 mol |
| D、t5~t6如阶段,容器内A的物质的量减少了0.03 mol,而此过程中容器与外界的热交换总量为a kJ,该反应的热化学方程式为3A(g)?B(g)+2C(g)△H=+100akJ?mol-1 |
| 时间/s | 0 | 20 | 40 | 60 | 80 | 100 |
| c(NO2)/mol?L-1 | 0.00 | 0.12 | 0.20 | 0.26 | 0.30 | 0.30 |
| A、升高温度该反应的平衡常数K减小 |
| B、20~40s 内,v(N2O4)=0.004mol?L-1?s1 |
| C、反应达平衡时,吸收的热量为0.30Q kJ |
| D、100s时再通入0.40mol N2O4,达新平衡时N2O4的转化率增大 |

 B(g)+2C(g);△H=+100akJ?mol-1
B(g)+2C(g);△H=+100akJ?mol-1 B(g)+2C(g);△H=+100akJ?mol-1
B(g)+2C(g);△H=+100akJ?mol-1湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com