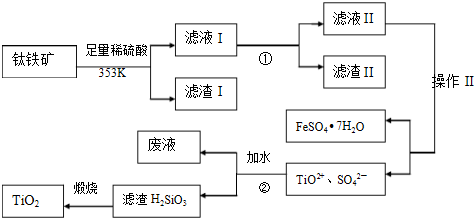
海水中含有丰富的化学元素,下面是某化工厂从海水中提取NaCl、Mg(以MgCl
2形式存在)和Br
2(以NaBr的形式存在)以及通过氯碱工业获得烧碱和氯气等化工原料的生产流程简图:
请回答:
(1)在粗盐中含有Ca
2+、Mg
2+、Fe
3+、SO
等杂质,精制时所用的试剂为:a.盐酸 b.氯化钡溶液 c.氢氧化钠溶液 d.碳酸钠溶液.则加入试剂的顺序是(填编号)
.
(2)氯碱工业为高耗能产业,一种用电解池燃料电池相结合的新工艺可节能30%.如图为工艺设计简图,根据图示回答以下问题:
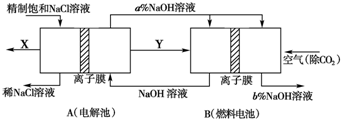
a.写出燃料电池中负极的电极反应式
.
b.比较NaOH溶液的浓度a
b(填>、<、=)
(3)Mg(OH)
2中加入盐酸后,要获得MgCl
2?6H
2O晶体,按所需的实验操作依次为
.
a.蒸馏 b.灼烧 c.过滤
d.在HCl气流中蒸发 e.冷却结晶
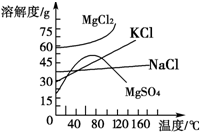
(4)母液中常含有MgCl
2、NaCl、MgSO
4、KCl等(其溶解度与温度的关系如图所示),可进一步加工制得一些重要的产品.若将母液加热升温到60℃以上,随着水分的蒸发,会逐渐析出晶体,此晶体的主要成分是
;过滤上述晶体后,将滤液降温到30℃以下,又逐渐析出晶体,用一定量的冷水洗涤该晶体,最后可得到比较纯净的
晶体.
(5)在母液中通入足量的Cl
2,然后用热空气将Br
2吹出,再用SO
2吸收,写出此过程发生反应的化学反应方程式
.

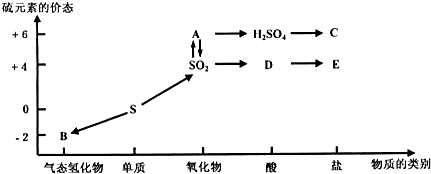
 (1)把物质进行分类,是认识物质的组成、结构、性质和用途的便捷途径.请用分类的方法来认识以下物质(填序号):①NaCl晶体 ②金属铜 ③盐酸 ④SO2 ⑤蔗糖
(1)把物质进行分类,是认识物质的组成、结构、性质和用途的便捷途径.请用分类的方法来认识以下物质(填序号):①NaCl晶体 ②金属铜 ③盐酸 ④SO2 ⑤蔗糖