
题目列表(包括答案和解析)
 实验室制备少量硝基苯的主要步骤如下:
实验室制备少量硝基苯的主要步骤如下:
| V3-(V2-V1) |
| 22400m |
| V3-(V2-V1) |
| 22400m |
 CuO
CuO CuSO4
CuSO4  Cu(NO3)2
Cu(NO3)2 Cu(OH)2
Cu(OH)2 CuSO4
CuSO4 CuSO4
CuSO4 CuO+SO2↑+SO3↑+O2↑为此他们设计了如图所示实验装置测定有关数据,并经计算确定该条件下CuSO4分解反应方程式中各物质的化学计量数.
CuO+SO2↑+SO3↑+O2↑为此他们设计了如图所示实验装置测定有关数据,并经计算确定该条件下CuSO4分解反应方程式中各物质的化学计量数.
(12分)I.下列是四组同学用铜制取硫酸铜晶体的方案:
甲组:将铜粉投入盛有稀硫酸的容器中,无反应。向容器底部缓缓鼓入氧气,溶液慢慢变蓝色,若在溶液中放置些铂丝,反应速率明显加快。
![]()
![]() 乙组: Cu CuO CuSO4
乙组: Cu CuO CuSO4
![]()
![]()
![]() 丙组: Cu Cu(NO3)2 Cu(OH)2 CuSO4
丙组: Cu Cu(NO3)2 Cu(OH)2 CuSO4
![]() 丁组: Cu CuSO4
丁组: Cu CuSO4
(1)甲组实验用一个化学反应方程式表示: ;
使反应变快的可能原因是 ;从该反应器溶液(含有少量H2SO4以抑制水解)中取得产品的实验操作步骤应为 、
过滤并洗涤晶体,取得产品后的残留物质可循环使用。
(2)可持续发展的原则要求化工生产①原理科学;②能量消耗低;③原料利用率高;④无污染。则在四组方案中, 组方案最好。
II.另一化学兴趣小组从化学手册上查得硫酸铜500℃以上按照下式分解:
CuSO4![]() CuO+SO2↑+SO3↑+O2↑
CuO+SO2↑+SO3↑+O2↑
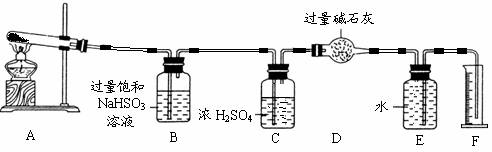 为此他们设计了如下图所示实验装置测定有关数据,并经计算确定该条件下CuSO4分解反应方程式中各物质的化学计量数。
为此他们设计了如下图所示实验装置测定有关数据,并经计算确定该条件下CuSO4分解反应方程式中各物质的化学计量数。
实验测得数据及有关结果如下;
①准确称取4.80g无水CuSO4;
②实验结束时干燥管D总质
量增加1.92g;③测得量筒F中水的体积,得出气体在标准状况下的体积为224.0mL。试回答下列问题:
(3)装置B的作用是 。
(4)装置C的作用是 。
(5)为减少测量气体体积引起的误差,应注意的事项有:
① 装置内气体的温度应恢复到室温,
② 调节量筒使其液面与E装置中的液面持平,
③ 。
(6)通过计算,推断出该条件下反应的化学方程式
| ||
| △ |
| ||
| △ |
| 硝酸银 |
| 氢氧化钠 |
| 稀H2SO4 |
| ||
| △ |
| ||

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com